
英语原文共 7 页,剩余内容已隐藏,支付完成后下载完整资料
研究比较在35和68度时银对黄铜矿的浸出动力学
E.M. Coacute;rdoba a, J.A. Muntilde;oz b, M.L. Blaacute;zquez b, F. Gonzaacute;lez b, A. Ballester b,
摘要:研究了银、铁离子浓度和含氧量对银催化黄铜矿浸出的影响。在pH1.8和初始氧化还原电位为500mV的Ag/AgCl的搅拌烧瓶(180rpm)中,在两种不同温度(35和68°C)下进行了浸出试验,其中矿物含量为0.5g,Fe3 /Fe2 硫酸盐溶液为100mL。添加多余的银有利于使黄铜矿转化为富含铜的硫化物,如铜篮、硫化铜、和吉尔(Cu8S5)。这些硫化物阻止了CuFeS2/Ag2S电偶的形成,从而导致了银的再生。此外,溶液中的氧在银离子的再生过程中起着关键作用,它是Ag2S的主要氧化剂。
关键词:银催化、黄铜矿、铁浸出、温度、氧气。
1.引言
黄铜矿是目前主要的铜矿物,它对氧化的反应非常强烈,可能与它的结晶结构和电化学特性有关(Forward和Warren, 1960)。这种硫化物的丰富以及更容易浸出矿物的短缺从而推动了动力学可盈利的加工。
添加银离子已经被考虑在催化湿法冶金黄铜矿的流程中。Miller和Portillo(1979)提出的反应模型仍被接受,以解释银离子的催化作用。在缺乏银离子的情况下,氧化黄铜矿伴随铁离子的浸出由于其矿物表面形成一层表现为扩散屏障的致密元素硫而导致浸出效率低下。然而,在银离子存在的情况下,黄铜矿浸出是根据以下的反应方案进行的:
CuFeS2 4Ag →Cu2 Fe2 2Ag2S (1)
Ag2S 2Fe3 →2Ag 2Fe2 So (2)
用银离子会使铜的萃取率更高,因为产中形成了So和不使黄铜矿表面钝化并且多孔的Ag2S。Price和Warren(1986)得出的结论是,这种催化过程中产生的元素硫,除了更多孔外,具有更高的导电性,促进了电子通过黄铜矿表面的传输。
先前,一些作者报道了银离子对硫酸铁溶解黄铜矿的有利影响,以及通过增加亚铁浓度延迟铁水解产物的成核作用(Coacute;rdoba等人,2007年)而对溶液中的Fe3 /Fe2 比值产生的有利影响。此外,与未催化黄铜矿浸出不同,铜的溶解速率随着氧化还原电位的增加而增加,因为Ag 的再生需要较高的铁浓度。在目前的研究中,银催化黄铜矿的浸出浓度的影响已经被研究使用不同的氧化剂(Fe3 和O2)。
2.实验步骤
2.1材料
采用Messina、Transvaal(南非)的黄铜矿矿物(约占CuFeS2的80%)进行了浸出试验,其化学成分为:34.30% S,29.65% Fe,27.36% Cu,0.31% Zn和0.02% Pb。粉末样品的XRD分析表明,黄铁矿(FeS2)、菱铁矿(FeCO3)和石英(SiO2)是矿物中主要杂质。
采用球磨机对矿石进行干磨,测得其比表面积为0.07 m2/g。激光脉冲法测定平均粒径为70mu;m。
2.2浸出解决方案
采用铁酸铁和硫酸亚铁的混合溶液配制出的浸出溶液,在pH为1.8的条件下,制备了初始氧化还原电位为500mV和Ag/AgCl的浸出液。在溶液中,总铁浓度保持在5或0.5 g/L。在35和68°C下分别用0K(修改9K培养基 Silverman和Lundgren,1959年)和Norris营养液(Norris和Barr,1985年)制备了用于低(35°C)和高(68°C)温度生物淋滤试验的原料溶液。
2.3浸出测试
所有浸出试验都在180转/分、恒温(35或68°C)的轨道振动筛上进行,有氧试验是在250毫升的水银柱上进行的,覆盖了疏水棉,允许氧气进入,但减少了水分的蒸发。100mL密闭烧瓶用于无氧试验。选择低浓度的0.5%(100毫升浸出液和0.5 g矿物)来防止液体介质在浸出时的氧化还原电位的急剧变化。在开始每次试验之前,在溶液中以硫酸银的形式加入银。
周期性的修复水的蒸发,在高于初值时调节pH值,记录氧化还原电位,并且移出1ml的样品溶液,用原子吸收分光光度法(Cu and FeTotal)和光比色法(Fe2 )来分析这溶液中的金属。最后,用XRD和SEM-EDS对固体残基进行分析。
3.结果与讨论
3.1银浓度的影响
反应(1)中,我们能得知在黄铜矿浸出时,我们可以得到银的产品,这些银可将会覆盖在黄铜矿表面,并且保护其免受黄钾铁矾和其他铁水解产物的钝化。在以前的研究中使用1g Ag/kg Cu,作者观察了整个实验的行为,除了最后一个阶段,没有催化作用可归因于银的损失(Coacute;rdoba等人,2007年)。
较高含量的银还可以防止黄铜矿的钝化。测试了三种不同的银浓度:1、10和50g/kg Cu,在温度(35和68°C)和使用5 g/L of FeTotal Fe3 /Fe2 硫酸溶液 (500 mV vs. Ag/AgCl)。
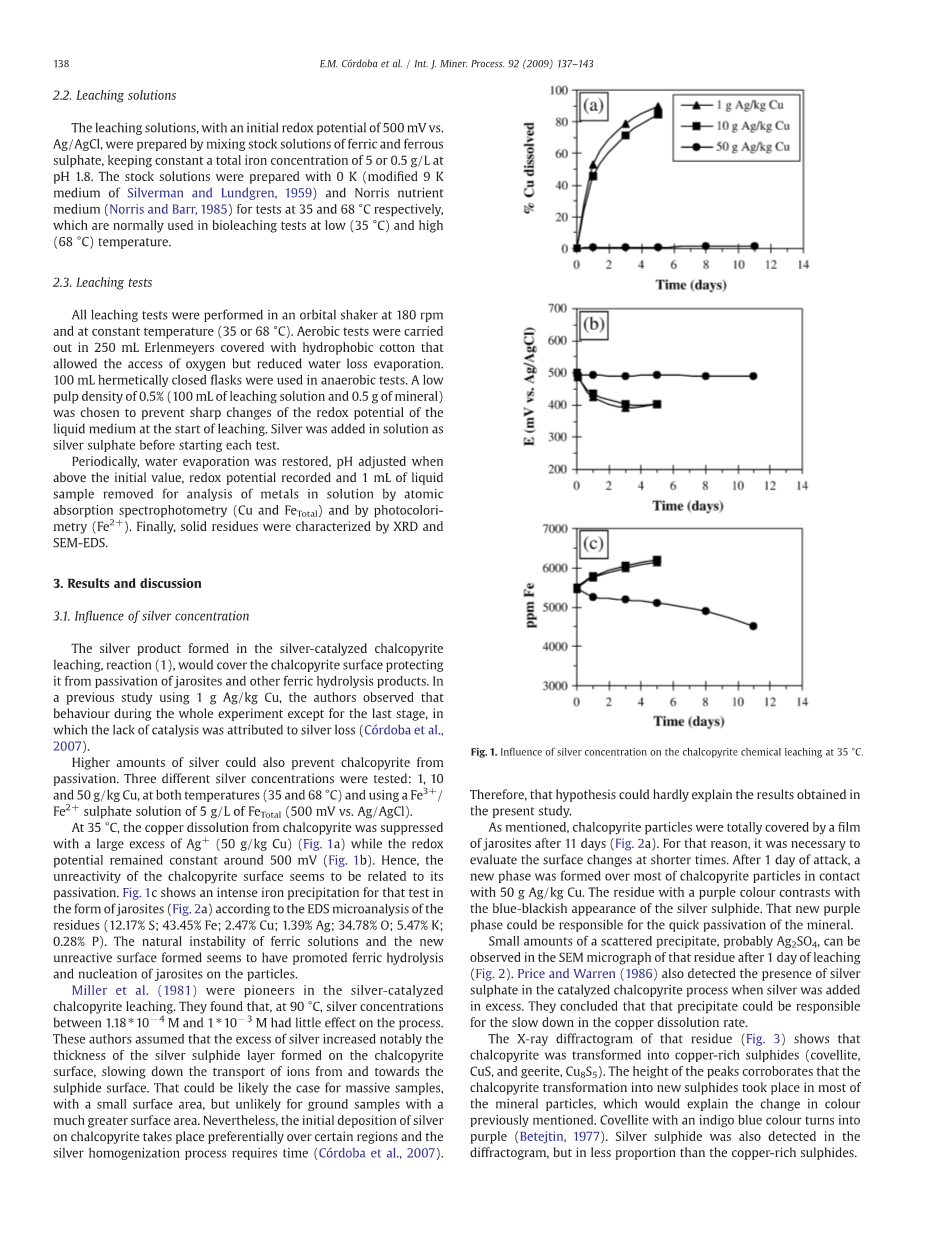
在35°C时,大量的Ag (50g/kg Cu)使黄铜矿中铜的溶解受到抑制。(图1a),同时氧化还原电位保持在500mV左右(图1b)。因此,黄铜矿表面的不活泼似乎与它的钝化有关。 图1c显示了以黄钾铁矾(图2a)形式出现的强烈的铁沉淀,根据EDS微区分析结果(12.17% S;43.45% Fe;2.47% Cu;1.39% Ag;34.78% O;5.47% K;0.28% P)。铁溶液的天然不稳定性和新的非活性表面的形成,似乎促进了铁水解和黄钾铁矾在颗粒上的形核。
米勒等人(1981年)是银催化黄铜矿浸出的先驱。他们发现,在90°C温度下,银浓度在1.18times;10minus;4M到1times;10minus;3M对该过程影响不大。这些作者认为,过量的银显著增加了黄铜矿表面形成的硫化银层的厚度,减缓了离子从硫化物表面和向硫化物表面的传输。对于表面积较小的大量样本来说,情况可能是这样,但对于表面积大得多的地面样本来说,情况可能并非如此。不过,在黄铜矿上初步沉积的银优先于某些区域,而且银均匀化过程需要时间(Coacute;rdoba等人,2007年)。因此,这一假设很难解释目前研究的结果。
图2在35°C添加50g Ag/kg Cu浸出渣的SEM显微图像:(a)11天;(b)1天 腐蚀
图1 35°C时银浓度对化学浸出黄铜矿的影响
如前所述,黄铜矿颗粒在11天后完全被黄钾铁矾膜所覆盖(图2a)。因此,有必要在较短的时间内对表面变化进行评估。在1天的腐蚀后,大多数与50g Ag/kg Cu接触的黄铜矿颗粒形成了一个新的相。残留物呈紫色,与硫化银的蓝黑色形成对比。新的紫色相可能导致这种矿物的快速钝化。
少量分散的沉淀物,可能是Ag2SO4,在经过1天的浸出后的SEM照片中可以观察到(图2)。Price and Warren(1986年)还发现,在催化黄铜矿过程中,当加入过量的银时,存在硫酸银。他们的结论是,这种沉淀可能是铜溶解速度减慢的原因。
残留物的X射线衍射(图3)表明黄铜矿转变为富铜硫化物(铜铬钴矿、硫化铜和吉尔,Cu8S5)。这些峰的高度证实了黄铜矿转化为新硫化物的情况发生在大多数矿物颗粒中,这就解释了前面提到的颜色变化的原因。蓝靛青色的铜铬钴合金会变成紫色(Betejtin,1977)。在衍射图上也发现了硫化银,但比例低于富铜硫化物。
图3 1天 (35 °C and 50 g Ag/kg Cu)条件下浸出残渣XRD衍射图
这些新的硫化铜将是由黄铜矿的固态转变的结果,并将解释在SEM显微图中无钝化产物的粒子出现,如图2b所示。
黄铜矿向其他富铜硫化物的固态转变可描述如下:
CuFeS2 2Ag →CuS Ag2S Fe2 (3)
3CuFeS2 6Ag 3/2O2 H2O→CuS Cu2S 3Ag2S 3Fe2 H2SO4 (4)
根据反应(3)、(4) CuFeS2的G°298 K为 minus;152.4和minus;302.6 kJ/mol,所以这是在热力学上是有利的(Roine,2002)。对于 Miller and Portillo (1979)提出的反应(1), CuFeS2的G°298 K为minus;224.9 kJ/mol。因此,在银的存在下,从黄铜矿的固态转变在热力学上更倾向于富铜硫化物(反应(4)),而不是它对铜和亚铁离子的溶解(反应(1))。
此外,在反应(4)之后,这种转变支持了Duyvesteyn和Saback(1993)的假设,即黄铜矿的实际公式是Cu2S.2CuS.3FeS.FeS2,而且黄铜矿浸出分解在这些硫化铜里。
根据以下的反应,硫化物的形成可以被铁离子溶解:
Cu2S 4Fe3 →2Cu2 4Fe2 So (5)
CuS 2Fe3 →Cu2 2Fe2 So (6)
然而,这些富铜硫化物在35°C下的铜溶解速度非常缓慢(图1)。这些结果与Acar等人(2005)观察在20°C铜蓝溶解速率相一致。Dutrizac等人(1985) 发现在5–94°C范围内,斑铜矿(Cu5FeS4)的铁浸出使富铜硫化物,共价铜是最难处理的。
由反应(3)和(4)衍生出来的模型,与Miller和Portillo(1979)提出的模型(反应(1)和(2))不同,假设黄铜矿中的铜不是释放到溶液中,而是形成新的矿物相,即铜蓝和吉尔(Cu8S5)(理论上的硬铜白云石)。根据这个模型,黄铜矿中的一些铁被溶解了。然而,在图1c(50g Ag/kgCu)中显示的溶液中铁的含量下降可能是由于其沉淀的缘故。
图3 在68°C下,银浓度对黄铜矿化学浸出的影响。
图4 在100times;(a)和1000times;(b)处的电子背散射扫描电镜(SEM)和在68°c浸取渣中加入50克的X射线衍射(c)Ag/kg Cu。
银的添加量超过,但比例较小,10克Ag/kg Cu不足以使黄铜矿完全固态转化为其他富铜硫化物。不象50克Ag/kg Cu中,铜的溶解速率略慢于1g的试验结果Ag/kg铜和银是一种有效的催化剂。
因此,过量的银有利于从黄铜矿到富铜硫化物的固态转变,与前硫化物不同的是,与硫化银接触后,这些硫化物不会优先溶解。
硫化银的溶解可以用反应(2)(Miller and Portillo, 1979)或反应(7)来描述。(Hu 等人, 2002)
Ag2S 2Fe3 →2Ag 2Fe2 So (2)
2Ag2S O2 4H →4Ag 2So 2H2lt;
全文共11585字,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[8932],资料为PDF文档或Word文档,PDF文档可免费转换为Word
以上是毕业论文外文翻译,课题毕业论文、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。


