
英语原文共 8 页,剩余内容已隐藏,支付完成后下载完整资料
金催化生产氯乙烯单体的研究进展
作者:Catherine J. Davies, Peter J. Miedziak, Gemma L. Brett, Graham J. Hutchings *
Cardiff University, Main Building, Park Place, Cardiff, CF10 3AT, UK
摘要:在这篇综述中,我们探讨了将金用于乙炔氢氯化反应的研究历史,并解析了导致其能越发商业化的近期发展。同时我们讨论了使用不同的前体和向金中添加第二金属作为改进这些催化剂的方法,并考虑了活性金物种的天然性质。尽管存在与之相关的环境问题,但是全球生产的绝大多数聚氯乙烯(PVC)仍然使用氯化汞作为催化剂。而由于中国政府同意在未来几年内消除PVC行业中的汞使用,所以人们显然需要找到一种替代催化剂;金在这一工艺中的潜在用途已经众所周知了几十年。迄今为止,金似乎是这一工艺的最佳选择,这主要是因为与其他金属相比,金具有更加优越的选择性。
copy;2016,中国科学院大连化学物理研究所
关键词:金,乙炔,氯化氢,氯乙烯单体,聚氯乙烯,催化作用
- 简介:氯乙烯单体(VCM)是制造聚氯乙烯(PVC)的单体,PVC是最常用的塑料之一,有着广泛的应用,例如用于包装、建筑材料,医疗器械和服装。这主要是由于使用添加剂有能够改变物质性质的能力,例如改变其硬度。因此,世界对塑料的需求量很大,每年生产超过4000万吨PVC,导致VCM成为了一种非常有价值的化学品。世界上绝大多数VCM(约90%)都用于制造PVC了,而其另外一个用途是制造氯化溶剂。
根据起始所用原料的不同,工业上生产氯乙烯的方法有很多种。在石油产量稳定且石油易得的国家,最常用的方法是平衡法,它是利用了乙烯氯化和氧氯化反应的组合,另一种更简单的方法是乙炔的直接氢氯化,这是一种煤衍生的起始材料法,这种反应传统上由碳支撑氯化汞催化。后一种方法是VCM的历史生产方法,由于廉价煤的供应,目前在中国普遍使用,每年以这种方式生产的VCM超过1300万吨。然而,汞基催化剂的失活是一个重大问题,除了活性降低之外,由于汞的毒性,从催化剂中浸出汞可能会出现问题。因此使用汞和继续使用这一工艺所产生的环境问题表明了工艺需要一种新的催化剂。事实上,《水俣汞使用公约》中有一条规定,2017年之后,新的氯乙烯装置将不允许使用汞催化剂,2022年之后,所有氯乙烯装置必须是无汞的。这导致了这一领域的研究重新兴起,因为需要一个新的,无汞催化剂而金正是一种很好的催化剂;在这篇综述中,我们讨论了其用于乙炔氢氯化反应的研究历史,并描述了导致其商业化的最新发展以及再该领域的持续研究。
2.金催化的开始:虽然负载型金属催化剂已经在工业过程中使用了几十年,但金在此类催化剂中的潜在用途是更加现代化的发展现状。大约在1980年左右两项重大发现使人们对金催化剂进行了大量的研究,以此来获得广泛的应用。Hutchings预测并随后证实,根据电极电位,金应该是乙炔氢氯化反应最活跃的金属,由碳负载金属氯化物催化剂催化[1,2]。同时Haruta等人[3]证明了以过渡金属氧化物(如Fe2O3)为载体的金纳米粒子在低温下对CO的催化氧化具有活性,尽管有报道称金催化剂会用于乙烯和丙烯的氧化[4]和烯烃的还原[5],但是这些新发现说明了金以纳米颗粒形式存在时作为催化剂的潜在用途。从那时起,对金催化作用的研究几乎成倍增加,导致2006年出版了第一本关于这一主题的书[6]。
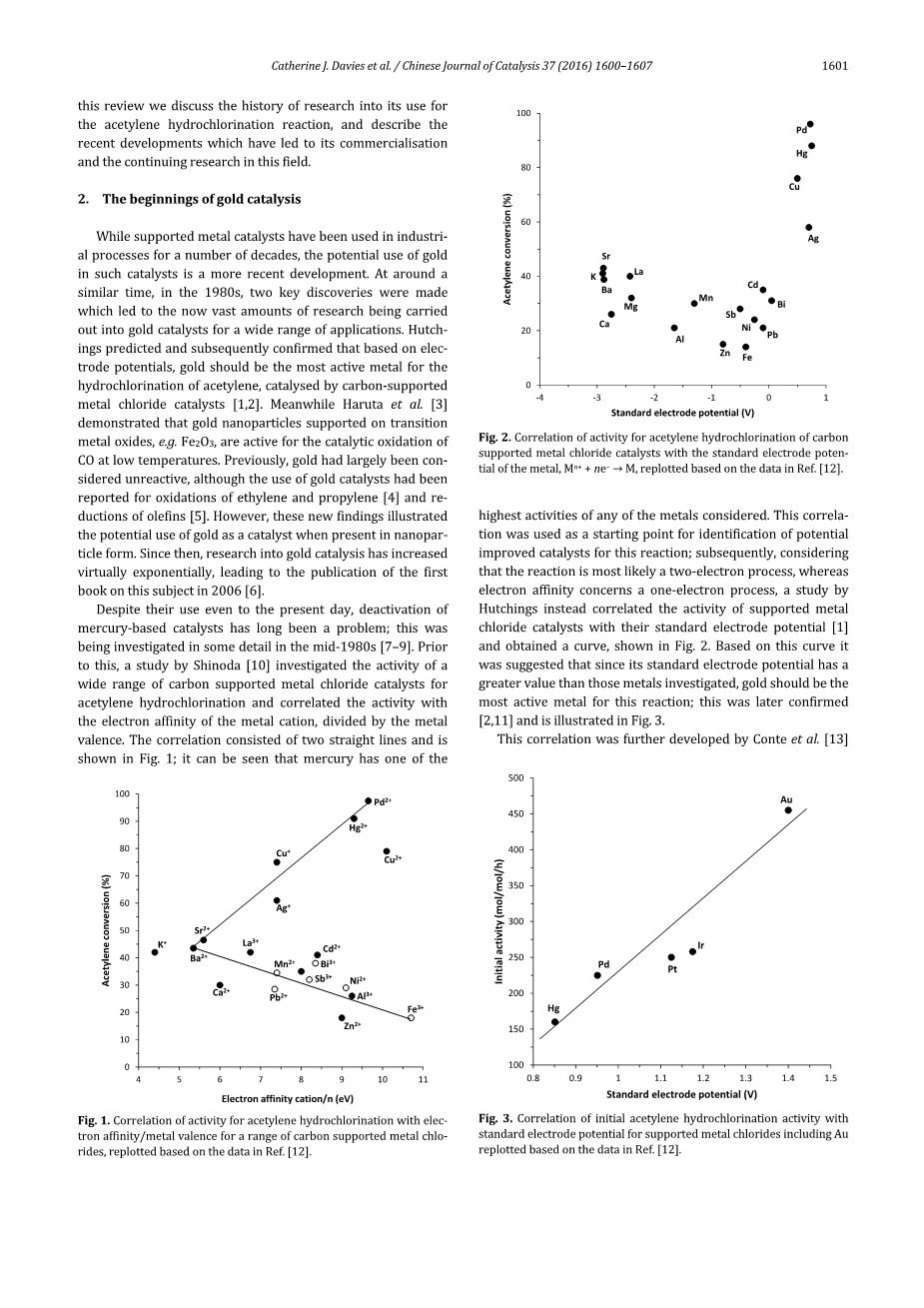
尽管汞基催化剂至今仍在使用,但它的失活长期以来一直是一个问题;1980年代中期[7–9]有人对此进行了详细的研究。在此之前,Shinoda[10]的一项研究调查了各种碳载金属氯化物催化剂的催化活性乙炔氢氯化反应,并将活性与金属阳离子的电子亲和力除以金属价关联。关联由两条直线组成,如图1所示;可以看出,汞在所考虑的所有金属中具有最高的活性之一。这种相关性被用作确定该反应潜在改进催化剂的起点;随后,考虑到该反应很可能是一个双电子过程,鉴于电子亲和力涉及一个单电子过程,Hutchings的一项研究将负载型金属氯化物催化剂的活性与其标准电极电位相关联[1],并得到了一条曲线,如图2所示。根据该曲线,有人认为,由于其标准电极电位比所研究的金属更高,因此金应是该反应最活跃的金属;这一点后来得到证实[2,11],如图3所示。
图1.乙炔氢氯化活性与一系列碳载金属氯化物的电子亲和性/金属价的相关性,根据参考文献[12]中的数据进行了补充。
图2.根据参考文献[12]中的数据,对碳负载金属氯化物催化剂的乙炔氢氯化活性与金属的标准电极电位Mn ne–→M的相关性进行了补充。
图3.根据参考文献[12]中的数据绘制了初始乙炔氢氯化活性与含金的负载金属氯化物的标准电极电位的相关性。
图4.负载型金属氯化物催化剂的初始乙炔氢氯化活性与相应金属的金属氯化物盐(RhCl6)3-,(RuCl5)2-,PdCl2,(PtCl6)2-,(IrCl6)3-和(AuCl4)-的标准电极电位的相关性,根据参考文献[13]中的数据进行了补充。
图5.反应温度对乙炔氢氯化Au/C催化剂失活率的影响,根据参考文献[12]中的数据进行了补充。
除了从金催化剂中观察到的最高活性外,另一个优点是发现它们对所需VCM具有更高的选择性,大于99.5%。然而,导致二氯乙烷生成的二次氢氯化反应通常与其他金属一起发生。且早期催化剂的失活仍然是一个问题,因此Nkosi等人[11]对此进行了研究,确定了虽然从载体中浸出金属氯化物是许多金属失去活性的主要原因,但金催化剂的情况并非如此。并且研究了反应温度对失活率的影响,观察到在100°C时出现最小失活率,且表明有两种不同的失活机制在运行(图5)。在60–100°C的温度下,发现失活是由于催化剂表面的含碳残留物沉积造成的,可能是聚合反应引起的,而在120–180°C时,这是由于阳离子金物种(Au(III)和Au(I))还原为Au0。尽管这表明100°C可能是最佳反应温度,但该温度下的活性被认为太低,因此继续使用约180℃的温度进行催化剂测试。
由于观察到阳离子金物种的还原对催化剂活性有害[14],随后一系列处理方法被应用于解决这个问题。并且结果表明这些处理方法能够通过金的再氧化来恢复催化剂的活性,这些催化剂在更高温度范围(180°C)的试验中失活[15]。同时发现了Cl2、NO和N2O都能有效地恢复催化剂的活性,而之前也有研究表明,用HCl处理的方法可用于催化剂再活化[16]。为了再生催化活性,金被重新氧化为其阳离子状态,这一点也得到了Conte等人[17]近期工作的支持,他们发现在反应器外X射线光电子能谱(XPS)和穆斯堡尔谱(Mossbauer spectroscopy)能用于确定催化剂表面存在Au3 ,通过王水沸腾处理失活催化剂,并将其与观察到的活性相关联。
此外,Conte等人[13]还对用于该反应的双金属金基催化剂进行了研究。他们的进一步研究中考察了向金中添加一系列贵金属的效果,在某些情况下,观察到了初始催化剂活性增强,而得出的结论是金催化剂仍然是最好的选择,这主要是由于金对所获得的所需产品具有更高的选择性[13]。最近,专家通过将铜[18]和镧[19]金属添加到金中的研究,得出了双金属催化剂的高活性和高选择性的报告,对Au-Cu/C催化剂的条件进行了优化,获得了大于99.5%的转化率和选择性,然而与单金属金催化剂研究中使用的870 h–1的气体小时空速相比的话,这使用了一种低至50 h–1的极其低的气体小时空速(GHSV)[20]。在这种情况下,镧的加入稳定了活性Au3 物种,提高了催化剂的寿命。
人们对乙炔氢氯化需要一种新催化剂的兴趣也导致了对金基催化剂的替代报道。这些催化剂包括机械活化的K2PdCl4、K2PtCl6和K2PtCl4盐[21–23]、离子液体[24]、Pt(II)络合物溶液[25],钯基催化剂[26]和液相铑催化剂[27]。
3.乙炔氢氯化反应机理:由乙炔在金催化剂上的氢氯化动力学研究发现,乙炔和HCl的反应均为一级反应[15],并发现了C2H2/Au/HCl络合物的形成。先前的研究也表明,该反应可能通过涉及阳离子金物种的氧化还原循环进行。尽管直到最近,对反应机理的研究还很少,但是,Conteet al.[20]现在已经对反应机理进行了详细的研究。在金属状态下,由于乙炔是一种还原剂,因此研究了各个反应物对催化剂的影响。一系列涉及催化剂在反应前和反应过程中连续暴露于各个反应物的实验发现,暴露于HCl可提高催化剂的活性,然而,暴露于乙炔导致催化剂失活。这在图6中得到了说明。此外,还发现催化剂的活性随在反应气体进料中HCl:C2H2比率的增加而不断增加。
由于乙炔的对称性,机械化的数据是无法获得的,因为每种可能的产物(合成和反合成以及马尔可夫和反马尔可夫产物)都是一模一样。同样,基于这个原因,专家用取代的炔烃进行了实验,发现活性受底物空间位阻的影响,观察到的趋势是乙炔(40%)gt;六炔(10%)gt;苯乙炔(7%)gt;六炔(2%)的活性。这些底物如图7所示。同时使用氘化底物(DCl)对这些反应进行的进一步研究得出结论,反应通过在碳-碳三元结构上反加HCl进行。
图7.用于研究穿过炔键添加HCl的机理的取代炔底物。(1)六炔;(2)苯乙炔;(3)六炔。
这个结果很重要,因为它意味着一个典型的Eley-Rideal机制,即只有乙炔吸附在金表面,HCl直接从气相与之反应,可以消除,由于这将导致合成加成。因此,建议使用[AuCl4]作为催化剂表面上的活性中心,形成C2H2/Au/HCl络合物的反应方案(图8)。
图8.乙炔在Au/C催化剂上氢氯化的拟议模型,涉及C2H2/Au/HCl络合物的形成,经参考文献[20]。
以C2H2、HCl和AuCl3为活性中心进行了DFT计算,Hashmi和AuCl3发表了关于金(III)活化炔烃的详细计算分析
研究人员[28,29]发现,由于五配位金原子的不稳定性,C2H2和HCl不太可能同时配位到Au3 中心,因此建议乙炔首先配位到金中心,然后从HCl分子中依次添加氯和氢与金中心的氯化物配体氢键连接。反应途径如图9所示。
图9.乙炔氢氯化在Au/C催化剂上的反应能量分布,假设催化剂表面的活性中心为AuCl3中心。能量单位为kJ/mol。过渡状态用 表示。经参考文献[20]许可复制。
Mitchenko等人[30]描述了机械活化铂和钯盐在室温下催化乙炔氢氯化的机理。第一步是碳-碳三键与金属的配位,然后,络合物的氯配体或HCl可能发生亲核攻击,在原去金属化后分别产生顺式和反式产物。在这种情况下,他们确定催化活性中心为带有配位空位的铂(IV)络合物,[PtCl5*],对于K2PtCl6和铂(II)乙炔,K2PtCl4盐的络合物。在这两种情况下,速率的决定步骤都被认为是
乙炔氯铂反应,涉及HCl分子。这一机制与金催化剂上的反应相似,因为它们都涉及炔烃与活性中心的配位,然后与氯化物相互作用。
- 现代发展:自2012年左右以来,世界对氢氯化无汞催化剂的研究数量大幅增加,因为这种变化不仅是可取的,而且在未来几年内是必要的。
即使是在乙炔氢氯化催化剂的最新研究中,使用负载金仍然是一个正在关注的核心理念,人们普遍认为,金必须高度分散并处于氧化状态,而金催化剂早已被证明对反应具有高度的活性和选择性,所以它们的稳定性仍然被认为是一个问题。人们试图通过多种方法来解决这一问题,例如添加额外的金属物种,使用替代载体,使用替代配体/浸渍方法对王水中的HAuCl4进行传统浸渍,所有这些都将在下面进行更详细的讨论。
文献中报道了许多最新的双金属催化剂,包括Au-Sr[33]、Au-Sn[34]、Au-Ba[35]、Au-Bi[36]、Au-Cs[37]和Au-Cu[38,39]。报道Au-Cs催化剂的同一组人也报道了具有改进活性的三金属催化剂,例如Au-Cs-Cu[40]和Au-Cs-In[38];还报告一种高活性的Au-Co-Cu催化剂了[41]。还研究了在活性炭载体上利用金属氧化物和Au的催化剂,例如CeO2[42]和TiO2[43]。在每种情况下,催化剂活性/稳定性的提高被认为是以下一个或多个因素的结果:Au3 的不可逆还原为Au0、Au的高分散性、表面积炭的抑制和反应物的吸附增强。但是,如前所述,重要的是要注意在比较催化剂测试结果时使用的反应条件-在许多情况下报告了极高的活性和选择性,但是使用的GHSV可能非常低。尽管用于该反应的大多数金催化剂使用活性炭载体,但也有少数情况下正在使用的其他载体,例如Al2O3[38,44]。
然而,使用替代配体是对传统金催化剂进行改进最为成功的方法,这导致了此类催化剂的商业化。在催化剂制备中使用王水增加了处理/回收/处置的重大成本。此外,从商业角度来看,在保持/提高催化剂寿命的同时降低载金量将具有显著的优势。Cartheyet等人[45]报告说,当使用王水制备催化剂时,载金量可降低至0.5 wt%,而不会显著降低活性;然而,王水的使用在碳上产生了催化聚合反应的强酸中心,这导致了碳纳米纤维的形成与催化剂失活。催化剂的重要发展步骤是将金前体从带有硬施主配体(Cl)的前体改为带有软施主配体的前体,特别是硫代硫酸盐(表1)。所有研究配体的详细信息见Johnston等人[46]从一个角度详细介绍了专利[45]和商业化的讨论,作者得出结论,与高稳定性常数形成高活性催化剂,因为金-硫键的稳定性有助于形成高度分散的稳定阳离子金物种。使用这些
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[259857],资料为PDF文档或Word文档,PDF文档可免费转换为Word
以上是毕业论文外文翻译,课题毕业论文、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。


