
英语原文共 18 页,剩余内容已隐藏,支付完成后下载完整资料
在健康与疾病中DNA感受的cGAS-STING通路
摘要
通过核酸传感器检测病原体是固有免疫的重要机理。RNA感应受体和DNA感应受体对外来核酸进行亚细胞区室取样检测,识别后触发宿主防御的免疫信号通路。在过去的十年中,我们越发理解核酸分子的识别是如何与免疫基因的表达相联系的,特别是DNA感应受体环GMP-AMP合成酶(cGAS)及其下游信号效应刺激器干扰素基因(STING),以及分子组件和监管的通路。此外,自身DNA参与cGAS成为了重要机制促进炎症的发展,并暗示cGAS–STING通路在人类炎症疾病和癌症中的作用。这一详细的机制和生物学的认知在治疗慢性炎症和癌症方面为药物诱导剂和拮抗剂的开发和临床应用奠定了基础。
模式识别受体可以预防感染,它可以识别微生物产物和触发信号通路,而这些信号通路协调抗菌素的防御并可激活适应性免疫。在过去的二十年里,通过识别微生物核酸来感知病原体已经成为哺乳动物细胞先天免疫的一个重要特征。异常的(5rsquo;三磷酸化的或5rsquo;二磷酸化的)单链和双链RNA或DNA, RNA-DNA杂交链和环二核苷酸均被认为是外来核苷酸。几十年来,人们认识到核酸具有强大的免疫刺激能力,并努力识别这些核酸分子所参与的受体和通路。
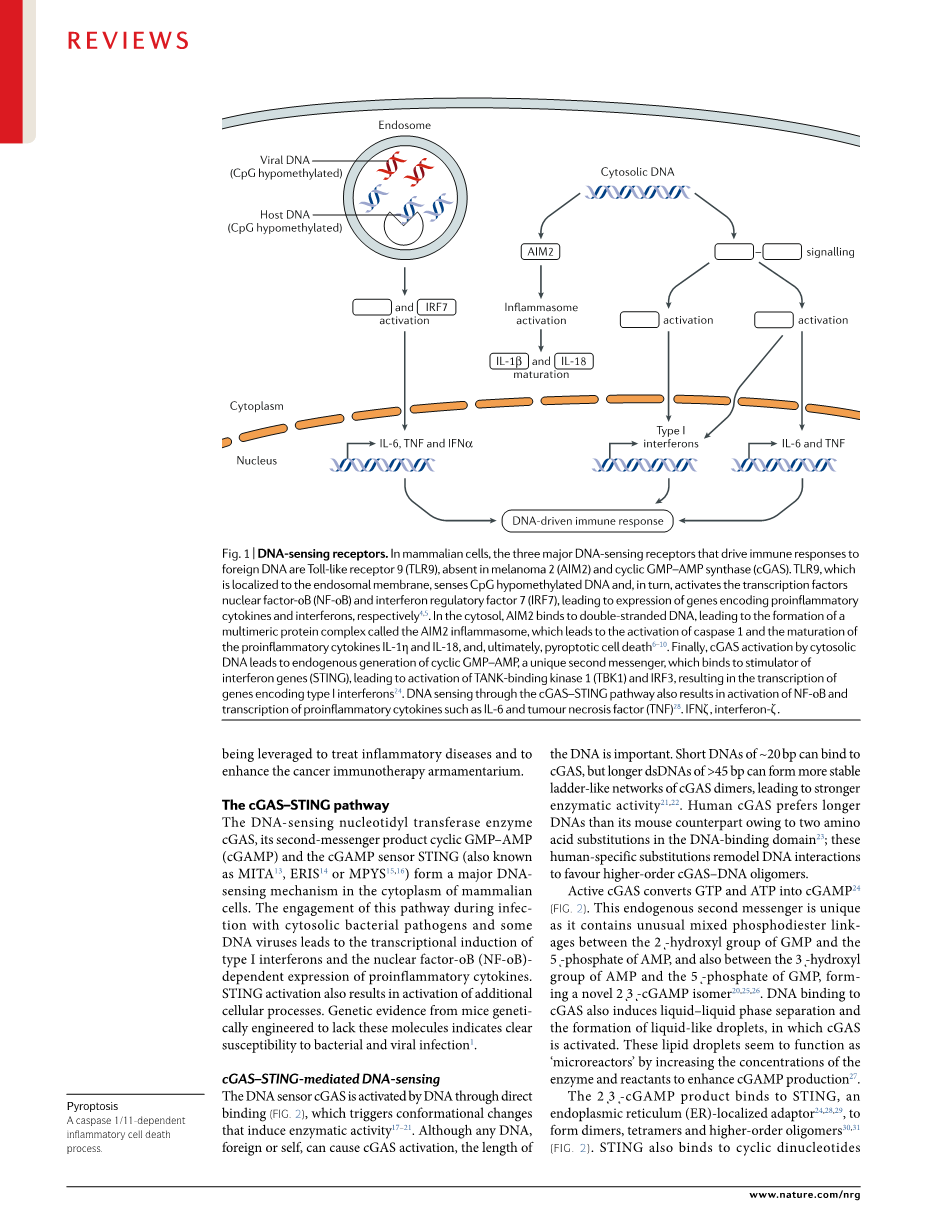
涉及RNA识别的通路已在其他地方进行了综述,因此在此将不再讨论。以DNA为例,我们在哺乳动物细胞中发现了三种重要受体,它们共同构成了目前我们对DNA驱动免疫反应的大部分理解—Toll样受体9 (TLR9),黑色素瘤2 (AIM2)和环GMP-AMP合成酶(cGAS)(图1)。TLR9表达于核内体膜,它收集取样胞外DNA,特别是通过吞噬溶酶体进入细胞的高甲基化DNA。TLR9在保护机体免受病毒和其他病原体侵害方面的重要性已被明确证实。双链DNA (dsDNA)通过进入胞质间触发AIM2炎症体,半胱天冬酶1型激活复合体的变型突变来控制水解成熟的促炎细胞因子ILshy;1beta;和ILshy;18以及活化可以介导细胞焦亡的成孔蛋白消皮素D。AIM2对DNA病毒和一些胞质细菌病原体的防御至关重要。迄今为止,次于胞质DNA积累的最显著的DNA输出是广泛转录程序的诱导,该程序包括编码I型干扰素的基因和大量干扰素刺激基因序列(ISGs);cGAS是一种DNA结合蛋白,可代表由下游适配器分子干扰素基因刺激器(STING)介导的反应的启动子。自2013年发现以来,我们逐渐理解其在宿主防御、自身免疫性疾病和癌症生物学中的作用。
(图1)
在这篇综述中,我们着重于目前对DNA传感的cGAS–STING通路的研究理解,描述胞质内cGAS受体是如何被激活的,下游信号是如何协调的,并详细介绍该通路的调节机制。我们还通过讨论人类遗传学是如何识别罕见的单基因疾病(通常由抑制cGAS-STING通路的基因突变引起)来了解这一通路。此外,我们还将cGAS-STING通路与无菌炎症性疾病的发展联系起来,并详述了cGAS-STING在癌症中的新作用。最后,我们强调如何利用这一通路的知识来治疗炎症疾病和提高癌症免疫疗法的医疗设备。
cGAS-STING通路
DNA感应核苷酸转移酶cGAS及其第二信使产物环GMP-AMP (cGAMP)和cGAMP传感器STING(也称为MITA、ERIS或MPYS)是哺乳动物细胞胞质中主要的DNA感应机制。在感染胞质细菌病原体和一些DNA病毒期间,该通路诱导I型干扰素和核转录因子kappa;B (NFshy;kappa;B)相关的促炎细胞因子的转录表达。STING的激活也会导致其他细胞过程的激活。使用基因工程消除这些分子的小鼠的遗传证据表明,小鼠对细菌和病毒感染具有明显的易感性,
cGAS-STING介导的DNA传感
DNA传感器cGAS是通过DNA直接结合激活的(图2),使cGAS构象变化,从而诱导酶活性。虽然无论是外来的还是自身的DNA,都能引起cGAS的激活,但DNA的长度是很重要的。20 bp左右的DNAs可以与cGAS结合,而长度大于45 bp的dsDNAs可以形成更稳定的梯状物如cGAS二聚体网络,其酶活更强。与小鼠相比,人源cGAS更喜欢较长的DNA,这是由于在DNA结合域有两个氨基酸取代;这些人类特有的取代改变了DNA间的相互作用,使其更倾向于高阶cGAS-DNA低聚物。
活化的cGAS将GTP和ATP转化为cGAMP(图2)。这个内生第二信使是独一无二的,因为它包含了特别的混合磷酸二酯键连接2rsquo;羟基GMP和5rsquo;磷酸AMP,也连接3rsquo;羟基AMP和5rsquo;磷酸GMP,形成奇特的2rsquo;3rsquo;-cGAMP异构体。DNA与cGAS的结合也会导致液-液相分离和液体如液滴的形成,从而激活cGAS。这些脂滴通过增加酶和反应物的浓度来增加cGAMP的产生,从而起到“微反应器”的作用。
(图2)
2rsquo;3rsquo;shy;cGAMP产物与定位于内质网(ER)的适配器STING结合,形成二聚体、四聚体和更高秩序寡聚物(图2)。STING也可以直接结合由细菌产生的环二核苷酸,包括环diGMP、环diAMP和细菌cGAMP,以及所有具有常见(3rsquo;5rsquo;)磷酸二酯键的。值得注意的是,在人类中,STING的等位基因突变可能导致对细菌环二核苷酸敏感性的改变。野生型STINGshy; R232突变可以同时由细菌环二核苷酸和2rsquo;3rsquo;shy;cGAMP激活,然而STINGshy; R232突变无法单个由细菌环二核苷酸激活。一般来说,与细菌环二核苷酸相比,STING与2rsquo;3rsquo;shy;cGAMP具有高亲和力,这表明当cGAS受体存在时,STING可以被更好地激活活化。
STING在与cGAMP结合过程中发生构象变化。蛋白质的两翼与配体并列位于捆绑的深口袋中,一个由四个反向平行beta;链组成的盖子重排在捆绑的口袋上面,形成封闭的构象。这种构象的改变导致了配体结合域的180°旋转,从而使二聚物STING分子并排堆积形成STING低聚物。除cGAMP和细菌环状二核苷酸外,其他几种刺激物也能激活STING(图2)。例如,由毒胡萝卜素诱导的内质网应激或被革兰氏阳性菌感染时产生的内质网应激可激活STING。此外,病毒膜融合已被证明可以触发STING的激活,并且不依赖于DNA感应。
在静息状态下,STING保存在内质网中,与Ca 2 传感器间质相互作用分子1 (STIM1)相互作用。在与cGAMP结合,构象改变后,STING通过内质网—高尔基体中间区(ERGIC)和高尔基体进行转运,其过程依赖于胞质外膜蛋白复合物II (COPII)和腺苷酸核糖基化作用因子(ARF) 鸟苷三磷酸酶 (图2)。STING在高尔基被棕榈酰化,这种翻译修饰对其激活至关重要。在STING易位于高尔基体之后,STING与TANK结合激酶1 (TBK1),Ikappa;B激酶(IKK)相关控制干扰素调节因子3 (IRF3)转录因子激活的激酶相互作用。在STING被TBK1直接磷酸化后,STING的羧基端尾部区域作为IRF3的对接位点,然后被TBK1磷酸化并激活。激活后的IRF3二聚体转移至细胞核调节干扰素beta;(IFNbeta;,I型干扰素)的转录翻译。通过自分泌和旁分泌信号,新生产的IFNbeta;结合并激活由IFNalpha;受体1 (IFNAR1)和IFNAR2组成的异质二聚体受体复合体。IFNAR1-IFNAR2复合体与酪氨酸蛋白激酶(JAK)信号转导和转录激活(STAT)信号通路结合,诱导多种ISGs的转录,其蛋白产物可阻止病毒的复制、组装和释放。
NFshy;kappa;B也被激活,并且可以控制促炎细胞因子和趋化因子的转录(图2)。肿瘤坏死因子(TNF)相关因子6 (TRAF6),NFshy;kappa;B基本调节器(NEMO),IKKbeta;和TBK1都涉及了STING依赖的NFshy;kappa;B的调节。TRIM32和TRIM56已被证明可以合成泛素链,结合NEMO,并且可能调节NEMO泛素化激活IKKbeta;,从而激活NFshy;kappa;B。最后,除了NFshy;kappa;B IRF3,STAT6是另一种可以被STING通路激活的转录因子;STAT6与STING相互作用,后被TBK1磷酸化,导致其二聚化并转位至细胞核,诱导一组特定的趋化因子的表达,包括CCL2、CCL20和CCL26,这些趋化因子在诱导抗病毒反应中非常重要。
STING的其他功能
cGAS-STING通路的同系物蛋白被发现于进化遥远的生物体上,这些生物体缺乏IRFs或NFshy;kappa;B如星状海葵,它是一种海葵,早于5亿年前就与人类产生了不同方向的进化。在哺乳动物STING中,羧基终端尾可以控制IRF,NFshy;kappa;B信号,星状海葵STING同系物中却缺乏羧基终端尾,这表明这一古老物种的STING,或许与哺乳动物STING相似,有着超出DNA传感的其他功能(图2)。
自我吞噬是STING的功能之一。在哺乳动物细胞中,含有STING的ERGIC是微管相关蛋白1A/1B-轻链3 (LC3)脂化的膜源,WD重复域磷酸化肌醇肽相互作用蛋白2 (WIPI2)和自噬蛋白5 (ATG5)是自噬小体形成的关键步骤。这种STING依赖的自噬反应有利于胞质中DNA的清除。STING诱导的自噬有利于保护果蝇免受结核分枝杆菌和革兰氏阳性菌的感染,抑制寨卡病毒的感染。在非吞噬细胞中,自噬有助于胞质DNA的清除,但自噬受损也可以诱导激活STING通路。
cGAS-STING通路也与其他细胞死亡途径相关,包括凋亡、焦亡和坏死。在人类中,胞质DNA触发STING依赖的NOD -、LRR -和pyrin结构域3 (NLRP3)通路来控制细胞死亡,而胞质DNA连接STING则诱导T细胞、幼稚B细胞或恶性B细胞的凋亡。通过cGAS-STING通路检测DNA也会激活相互作用的丝氨酸/苏氨酸蛋白激酶3 (RIPK3)受体,并且诱导由骨髓衍生出的巨噬细胞的坏死性凋亡。这一通路同时需要I型干扰素受体和肿瘤坏死因子受体(TNFRs)来传递信号,揭示了这些通路诱导细胞死亡的协同作用。此外,诱导细胞坏死MLKL的执行者也是由STING依赖的I型干扰素来调控。
病原体激活cGAS-STING通路
DNA病毒,如单疱疹病毒1型(HSV1)、HSV2、腺病毒、小鼠疱疹病毒68型、牛痘病毒、巨细胞病毒和乳头瘤病毒,由cGAS-STING通路下游的I型干扰素控制。例如缺乏cGAS或STING的小鼠无法诱导I型干扰素反应,因此易受这些病毒病原体的感染。除DNA病毒外,HIV、SIV、小鼠白血病病毒等逆转录病毒也可激活cGAS。其他一些RNA病毒也会受cGAS-STING通路的影响。例如,cGAS可以保护小鼠免受西尼罗病毒和登革病毒的感染,但其机制仍是未知。当感染登革病毒时,线粒体DNA被释放到受感染细胞的胞浆中,激活cGAS并引发保护性I型干扰素应答。其他一些RNA病毒,如疱疹性口炎病毒(VSV)可以激活STING,然而,与其他病毒病原体不同的是,VSV感染期间的STING激活会导致蛋白质翻译受阻,从而限制了病毒的复制。
除了病毒外,革兰氏阳性菌细和革兰氏阴性细菌都能激活cGAS-STING通路。单核李斯特菌产生环二腺苷酸,环二腺苷酸可以直接与STING结合,从而激活STING而不通过cGAS,然而对于其他细菌来说,如结核分枝杆菌、B群链球菌、军团菌属细菌、李斯特菌、志贺氏菌、弗朗西斯菌、衣原体和奈瑟菌等,则通过cGAS识别微生物DNA,然后通过cGAMP激活STING。
cGAS-STING通路的调节
cGAS-STING信号下游诱导的I型干扰素和炎性细胞因子是保护宿主不受感染的关键。然而,这些细胞因子如果产生过多或存在时间过长是很危险的,会导致组织损伤和免疫病理反应。意料之中的是,许多调节机制,包括配体有效性和翻译后的修饰或蛋白-蛋白相互作用,均可以改变cGAS或STING的稳定性、活性和转运,抑制cGAS - STING通路,以保持免疫平衡(表1)。
配体有效性
当cGAS不依赖序列,与dsDNA结合时,外源DNA和宿主DNA都可以激活 cGAS–STING通路。因此,控制宿主dsDNA的可获得性是预防错误激活通路的关键。有两个关键机制可以确保cGAS不会遇到宿主dsDNA。
第一种机制是有关降解dsDNA的DNase酶,从而保证cGAS配体的有效性(图3a)。健康细胞胞浆内的DNA积累受到不同亚细胞区的DNase酶的限制。DNases存在于细胞外(DNase I和DNase I样3 (DNase IL3)),在吞噬溶酶体内(DNase II)或胞质内(3rsquo;端修复外切酶1 (TREX1;也被称为DNase III)),共同确保自身DNA无法积累,无法与cGAS或其他传感器相结合。
图3a
第二种机制是区域化的;DNA被隔离在健康细胞的细胞核或线粒体中,而cGAS主要位于细胞质中,因此cGAS无法接触到它。然而,新的证据表明,cGAS也可以定位于质膜或细胞核(box 1)。虽然DNA配体和它们的胞质受体在健康细胞中是分离的,但在某些条件下,这种区域化就会被破坏了。例如,细胞分裂,在这一过程中核膜被迅速溶解,这就给区域化的概念提出了一个难题。同样,线粒体DNA可以在线粒体受损或细胞凋亡时进入细胞质。因此,肯定存在其他机制来限制这种情况下的cGAS-DNA接触。
通路激活状态
在cGAS - cgamp - STING通路中,多种调控机制对其激活状态起着积极和消极的调节作用,具体表现为通过翻译后的修饰或蛋白-蛋白相互作用来调节cGAS或STING的稳定性、活性和转运(表1)。
消极调节。抑制cGAS-STING信号的负调节有很多级(表1)。在没有感染的情况下,静息细胞中,cGAS的表达水平在翻译后通过自噬进行调节,以限制cGAS蛋白的水平。Beclin 1是一种自噬蛋白,以DNA依赖的方式与cGAS相互作用,当病毒感染时,它的酶活性会受阻,这表明自噬机制可以调节cGAS的活性和表达水平。额外的翻译后的修饰也可以负调控cGAS,包括磷酸化、乙酰化、单谷氨酰胺化和多谷氨酰胺化。炎症性和凋亡性半胱氨酸蛋白酶也可以裂解cGAS,而cGAS的激活也会受到消皮素D (AIM2炎症小体的下游)
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[240057],资料为PDF文档或Word文档,PDF文档可免费转换为Word
以上是毕业论文外文翻译,课题毕业论文、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。
您可能感兴趣的文章
- 纳米材料介导镉污染土壤原位修复的机理及研究进展外文翻译资料
- 纳米零价铁磁洗受镉污染水稻土壤的有效性验证外文翻译资料
- 镉对水稻叶片生长和养分运输的短期影响外文翻译资料
- 间接竞争ELISA的研制及可视化基于金纳米棒生长的多色酶联免疫吸附试验玉米赤霉烯酮的测定外文翻译资料
- 铅(Pb)诱导的小麦根系生化和超微结构变化外文翻译资料
- 用蚕豆根尖微核试验评估污水灌溉区和生物修复区土壤的遗传毒性外文翻译资料
- 镧在红土壤中的生物累积和其对玉米幼苗生长的影响外文翻译资料
- 铈对水稻幼苗生长及部分抗氧化代谢的影响外文翻译资料
- 用黄体孢子菌沉淀碳酸盐固定有毒金属的体外研究及其在含硫化物尾矿中的应用外文翻译资料
- 水牛妊娠早期生物标志物的编码序列克隆及部分序列密码优化后在大肠杆菌中的表达外文翻译资料


