马吕斯红果查耳酮合成酶基因、McCHS、调节红色花瓣的颜色和类黄酮的生物合成
Deqiang Tai 1,3.,Ji Tian 1,2. , Jie Zhang 1,2. , Tingting Song 1,2 , Yuncong Yao 1,2
1 中国北京农业大学植物,科学和技术,2 中国北京农业大学, 重点实验室北京农业新技术的应用,3、中国山西农业大学园艺学院,
摘要:查耳酮合成酶是一个关键酶,并且经常通过病原反应酶的生物反应合成花青素色素积累在植物器官如鲜花和水果,但是CHS表达之间的关系和不同品种的花瓣颜色水平尚不清楚。在这项研究中,三种典型海棠品种选择基于不同的花瓣颜色和颜色模式。两种极端的颜色品种,“皇室”和“火焰”,分别有深红色和白色花瓣,中间品种“辐射”粉红色的花瓣。我们发现等的表达水平积累和McCHS花瓣扩张过程中在不同的品种。结果显示McCHS有他们特殊的表达模式在每个品种进行了测试,并负责海棠花瓣的红颜色和色调变化,特别是对于颜色消退过程中“辐射”。此外,烟草植物表达McCHS显示较高的花青素积累起来从而更深的红色花瓣的颜色与控制未转化线。此外,几个花青素生物合成基因的表达水平高于转基因McCHS 表达烟草行比控制植物。关系密切观察McCHS的表达与转录因子McMYB4和McMYB5花瓣海棠品种的发展,表明McCHS受这些转录因子的表达。我们得出这样的结论:内生McCHS花青素生物合成调节有关,基因是一个关键因素在马吕斯的花瓣颜色红果。
引文:大D,田J,张J,歌T,姚明Y(2014)马吕斯红果查耳酮合成酶基因,McCHS,调节红色花瓣颜色和类黄酮生物合成。《公共科学图书馆bull;综合》9(10):e110570。doi:10.1371 / journal.pone.0110570
编辑:Xianlong张,作物遗传改良国家重点实验室,中国
收到6月14日,2014;接受9月15日,2014年,10月30日,2014年出版
版权:2014大et al。这是一个开放的文章下分布式知识共享归属许可条款,允许无限制的
用、分配和复制在任何媒介,被认为提供了原作者和来源。
数据可用性:作者确认所有可用数据的发现完全没有限制。在纸和它的所有相关数据
支持文件的信息。
项目提供的资金:金融支持创新团队建设,对高校教师职业生涯发展在北京市(IDHT20140509)中国国家自然科学基金(31301762)和国家现代农业科技城成就为人们服务技术示范项目(Z121100007412003)。投资者没有参与研究设计、数据收集和分析,决定发表,或准备的手稿。
利益冲突:作者已经宣布,不存在利益冲突。
*电子邮件:yaoyc_20@126.com
*这些作者的贡献同样这项工作。
介绍:
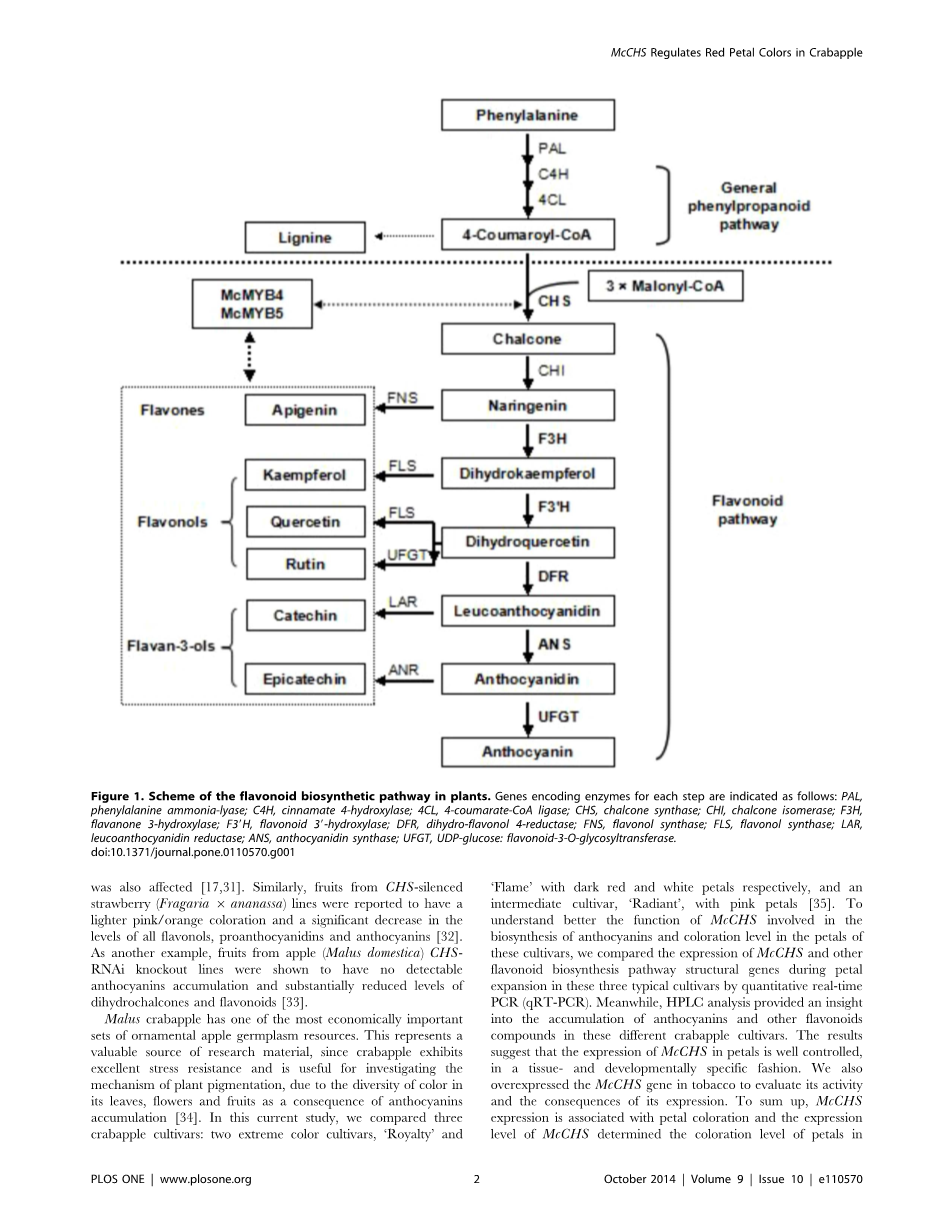
植物phenylpropanoid大量化合物的生物合成途径导致形成参与多种生理和生化过程[1]。一些研究这些化合物的例子包括花青素、黄酮醇含有花青素类黄酮的家庭,色素沉着中发挥核心作用的植物器官,种子萌发,紫外线保护和防御病原体和生物应力(2 - 8)。先前的研究主要集中在拟南芥花青素生物合成[9],佩妮矮牵牛[10],玉蜀黍[11]和马吕斯有明显(12 - 13),和花青素生物合成的基因特征,是由三个类转录因子(TFs):MYB、基本helix-loop-helix(bHLH)和WD40蛋白质(14 - 16)。查耳酮合成酶的催化反应(CHS)被认为是监管的关键一步合成黄酮类化合物的催化一个分子的凝聚与三个分子丙二酰基- - CoA 4-coumaroyl-CoA形成柚苷配基查耳酮,许多花的主要色素,树叶和水果(17 - 19)。事实上,类化合物提供了范围广泛的类黄酮的结构前体,黄酮醇、黄烷酮类,花青素苷和其他衍生化合物(图1)。因此,有很多兴趣CHS及其参与植物生理学和生物化学的许多方面。
第一CHS基因克隆从欧芹(Petroselinum crispum)在1983年[20],自那时以来,许多CHS基因已经被隔离,主要从单子叶植物和双子叶植物,包括豆科植物大豆(大豆),紫花苜蓿(紫花苜蓿),豌豆(Pisum一,a芥,大麦(大麦),玉米(玉米)、葡萄(葡萄)和其他[-]。CHS序列高度保守的蛋白质在不同植物[28],与大约80 - 90%的氨基酸同源性[29],CHS基因的分子进化分析表明他们无处不在的植物中,包括早期陆生植物和藻类的轮藻纲[30]。
CHS的上下文中已经深入研究花青素色素的合成和积累和几个报告所描述的影响改变CHS表达转基因植物。例如,佩妮的反义CHS基因的表达导致苍白色的花朵,甚至白色,由于抑制花青素生产,和植物生育也影响[17日31日]。同样,从CHS-silenced草莓水果(草莓属6 ananassa)据报道行浅粉红色/橙色颜色和黄酮醇的含量显著下降,原花青素,花青素[32]。另外一个例子,水果从苹果(苹果属有)CHS-RNAi淘汰赛线被证明没有检测到花青素积累和大幅减少dihydrochalcones和类黄酮[33]。
图1所示。方案的类黄酮生物合成途径在植物。基因编码酶为每个步骤说明如下:苯丙氨酸ammonia-lyase,C4H,肉桂酸4-hydroxylase;4 cl,4-coumarate-CoA连接酶;CHS,查耳酮合成酶;气,查耳酮异构酶;F3H,黄烷酮3-hydroxylase;F39H,类黄酮39-hydroxylase;DFR,dihydro-flavonol 4-reductase;fn,黄酮醇合成酶;FLS的,黄酮醇合成酶;守护神,leucoanthocyanidin还原酶;ANS,花青素合成酶;UFGT,UDP-glucose:flavonoid-3-O-glycosyltransferase。doi:10.1371 / journal.pone.0110570.g001
图1所示。方案的类黄酮生物合成途径在植物。基因编码酶为每个步骤说明如下:朋友,苯丙氨酸ammonia-lyase,C4H,肉桂酸4-hydroxylase;4 cl,4-coumarate-CoA连接酶;CHS,查耳酮合成酶;气,查耳酮异构酶;F3H,黄烷酮3-hydroxylase;F39H,类黄酮39-hydroxylase;DFR,dihydro-flavonol 4-reductase;fn,黄酮醇合成酶;FLS的,黄酮醇合成酶;守护神,leucoanthocyanidin还原酶;ANS,花青素合成酶;UFGT,UDP-glucose:flavonoid-3-O-glycosyltransferase。doi:10.1371 / journal.pone.0110570.g001图1所示。方案的类黄酮生物合成途径在植物。基因编码酶为每个步骤说明如下:朋友,苯丙氨酸ammonia-lyase,C4H,肉桂酸4-hydroxylase;4 cl,4-coumarate-CoA连接酶;CHS,查耳酮合成酶;气,查耳酮异构酶;F3H,黄烷酮3-hydroxylase;F39H,类黄酮39-hydroxylase;DFR,dihydro-flavonol 4-reductase;fn,黄酮醇合成酶;FLS的,黄酮醇合成酶;守护神,leucoanthocyanidin还原酶;ANS,花青素合成酶;UFGT,UDP-glucose:flavonoid-3-O-glycosyltransferase。
doi:10.1371 / journal.pone.0110570.g001
结果:
三个马吕斯海棠品种的花瓣表型,“皇室”,“辐射”和“火焰”
三个马吕斯海棠品种的花瓣表型,“皇室”,“辐射”和“火焰”,如图2所示。皇室的花瓣在舞台上我是深红色,在开花和明亮的颜色变得更加生动,最终达到最大颜色强度在四期的盛开。在后期V,盛开后,色素消退,削弱了(图2 b)。“火焰”阶段的花瓣我给一个明显的红色光,从阶段第二阶段V时,颜色渐渐微弱,最终花瓣变白(图2 d)。有趣的是,“辐射”的花瓣是红色的在舞台上我,和颜色逐渐变成粉红色花瓣扩张(图2)。总的来说,“皇室”最红和鲜艳的花朵,而lsquo;火焰rsquo;花瓣几乎是白色花瓣发展期间,和“辐射”花瓣有明显颜色褪色过程花瓣扩张。接下来,它决定如何anthocy-anins颜色的三个典型的品种。
三种马吕斯海棠品种花瓣中黄酮类成分的量化和鉴定
洞察马吕斯的海棠花瓣类黄酮成分及其品种之间的差异,两个花青素的含量(花青色素和天竺葵色素)和其他五类黄酮测定三个品种的花瓣(图2 e)。符合红色品种的花瓣颜色观察Royalty”,丰富的花青素是明显高于其他两个品种,并逐渐减少花青素发生在花瓣发展,而花青素只有白色cultiver中发现的火焰在第一阶段的花瓣。槲皮素和芹菜甙元显示相同的时空模式,积累和丰富的这些化合物也在三个品种的花瓣发展有所下降。芦丁有类似的概要槲皮素和芹菜甙元,大幅降低到检测不到的水平,除了在II期“火焰”。相比之下,“火焰”花瓣的儿茶素含量远高于“皇室”和“辐射”,花瓣和儿茶素只有在发展的第一阶段“皇室”和Radiant的花瓣。作为proanthocyanidin的前身,儿茶素的积累表明proanthocyanidin无色的主要黄酮类化合物组织和与其他color-petal品种相比,proanthocyanidin的生物合成途径是主要的类黄酮生物合成途径Flame的分支。此外,“皇室”花瓣的山柰酚含量几乎是相同的与其他两个品种在第一阶段的发展和减少花瓣,山柰酚内容在“辐射”和“火焰”从第二阶段几乎没有可检测到第五阶段(图2 e)。
描述的马吕斯红果McCHS基因
基于对马吕斯6有序列的同源性和相关序列在基因组数据库中蔷薇科(http://www.rosaceae.org),一个全长基因序列CHS(McCHS)放大的总RNA马吕斯红果Royalty rt - pcr和种族的叶子。具体来说,加入McCHS cDNA(没有。FJ599763)是1529年英国石油公司在长度和预测编码389个氨基酸的蛋白质以CHS基因高度同源的物种(图3),包括马吕斯有明显(MdCHS2;99%的身份),马吕斯有明显(MdCHS1;99%的身份),马吕斯有明显(MdCHS320;99%的身份),Pyrus bretschneideri(PbCHS;98%的身份),马吕斯有明显(身份MdCHS46;94%)等等。看来查耳酮合成酶蛋白质序列发生了小序列物种多样化的检查,他们是高度相似的长度在不同的植物物种。除了公认的CHS基因序列,也有相关序列更发散特征CHS基因,尽管这些基因显示高序列相似性草莓属ananassa CHS(FrCHS;AB201756),如悬钩子属植物idaeus(RiPKS-5;EF694718;97%的身份),其功能还有待确定。集体,他们被描述为酮化合物合酶(PKS)基因,更一般的描述CHS和CHS-Like基因家族(图3 b)。
我们执行中存在确定的表达McCHS花瓣发育期间的三个海棠品种(图3 c)。相比,在无色品种,McCHS在“皇室”的相对表达水平更高,而McCHS难以觉察的成绩单是在lsquo;火焰rsquo;花瓣,除了在四期。在“皇室”和“辐射”花瓣发展之间的转录水平逐渐下降。结果显示McCHS的表达水平是一致的花瓣颜色和花青素积累的变化在不同的海棠品种,和McCHS诱导表达强度的海棠花瓣色素水平。此外,“辐射”花瓣的颜色变化是引起McCHS转录水平的下调。
McCHS在树叶和水果成熟度的表情也被调查的三个品种。叶的表型,水果肉和水果果皮如图S1。当比较叶子,McCHS的最高表达是在“辐射”,价值超过twicethatof”皇室andfour *要高“火焰”(图4)。McCHS transcriptsweremostabundant intheflesh和果皮的“火焰”水果,但他们几乎无法觉察的果皮的“皇室”和“辐射”(图4)。表达谱的水果肉,McCHS与叶表现出相反的趋势(图4)。这些结果表明,McCHS有不同的表达模式在不同的组织/器官中这三个品种,所以我们推断McCHS的表达可能还参与其他类黄酮化合物的生物合成。作为重要的因素来确定叶子的颜色,三个品种的叶绿素含量叶以五developmentstages theresultssuggestedthatthechlorophyllcontent是高ever-red-leaf皇室的叶子比spring-red-leaf Radiant”和ever-green-leaf“火焰”,并逐渐减少与叶子的发展红果。所以红果的红色的叶子颜色取决于McCHS花青素的积累和表达,而不是叶绿素含量(图4 b)。
类黄酮生物合成基因的RNA表达谱在马吕斯海棠花瓣
进一步证实CHS监管其他花青素生物合成的基因如何影响花青素生物合成,我们分析了花青素生物合成基因的表达都位于下游的McCHS(图5)。McF3H下游基因的表达水平,McF39H,McDFR,McANS和McUFGT几乎所有高“皇室”比“火焰”和“辐射”花瓣花瓣发展阶段,一个例外是McUFGT II期。在某种程度上,McF3H的表达模式,McF39H McDFR显示,类似的模式在三个马吕斯海棠品种,黄酮醇水平密切相关(图2 e和5)。虽然McF3H的表达,McF39H和McDFR“辐射”和Flame的花瓣是McCHS相似,但不是“皇室”。最重要的是,McCHS显示相同的时空表达模式McANS McUFGT在所有三个品种。综上所述,结果oftranscriptionallevel建议McCHS基因调节类黄酮生物合成基因植物的颜色。
图2。花发育一系列三马吕斯海棠品种。(A)的典型花表型马吕斯红果“皇室”,“辐射”和“火焰”通过发展品
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 13 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[286458],资料为PDF文档或Word文档,PDF文档可免费转换为Word
以上是毕业论文外文翻译,课题毕业论文、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。
您可能感兴趣的文章
- 纳米材料介导镉污染土壤原位修复的机理及研究进展外文翻译资料
- 纳米零价铁磁洗受镉污染水稻土壤的有效性验证外文翻译资料
- 镉对水稻叶片生长和养分运输的短期影响外文翻译资料
- 间接竞争ELISA的研制及可视化基于金纳米棒生长的多色酶联免疫吸附试验玉米赤霉烯酮的测定外文翻译资料
- 铅(Pb)诱导的小麦根系生化和超微结构变化外文翻译资料
- 用蚕豆根尖微核试验评估污水灌溉区和生物修复区土壤的遗传毒性外文翻译资料
- 镧在红土壤中的生物累积和其对玉米幼苗生长的影响外文翻译资料
- 铈对水稻幼苗生长及部分抗氧化代谢的影响外文翻译资料
- 用黄体孢子菌沉淀碳酸盐固定有毒金属的体外研究及其在含硫化物尾矿中的应用外文翻译资料
- 水牛妊娠早期生物标志物的编码序列克隆及部分序列密码优化后在大肠杆菌中的表达外文翻译资料


