
英语原文共 24 页,剩余内容已隐藏,支付完成后下载完整资料
泛素修饰
柯比N斯瓦特克1,大卫科曼德1
np
1医学研究委员会分子生物学实验室,弗朗西斯克里克大道,剑桥,CB2 0QH,英国
蛋白质泛素化是一种动态多方面的翻译后修饰,涉及真核生物学的几乎所有方面。一旦连接到底物,76-氨基酸的蛋白质泛素进行进一步修饰,产生具有不同细胞结果的众多不同信号,称为“泛素密码”。泛素蛋白可以在七个赖氨酸(Lys)残基或N-末端上泛素化,形成可包含复杂拓扑的多聚泛素蛋白链。备选地或另外地,泛素蛋白Lys残基可以被类泛素蛋白分子(例如SUMO或NEDD8)修饰。最后,泛素还可以在赖氨酸上被乙酰化,或者在丝氨酸,苏氨酸或酪氨酸残基上被磷酸化,并且每种修饰都有可能显著改变信号传导结果。尽管细胞中明显修饰的泛素蛋白种类的数量是令人难以置信的,但是已经取得很多进展来表征不同的泛素修饰的作用,并且已经鉴定出许多酶和受体来产生,识别或去除这些泛素修饰。我们在这里概述了细胞中存在的各种泛素修饰,并强调了泛素链生物学的最新进展。然后,我们将讨论泛素乙酰化和磷酸化领域的最新发现,重点关注Ser65-磷酸化及其在线粒体自噬和帕金激活中的作用。
关键词:泛素; 蛋白酶体降解; 磷酸化; 翻译后修饰; 帕金
简介
Goldknopf等人实现的组蛋白被蛋白泛素通过赖氨酸连接的异肽键[1]修饰,标志着翻译后信号的新时代。当时,已知氨基酸的小化学修饰(包括磷酸化和乙酰化)调节蛋白质功能[2,3]。基于蛋白质修饰的流行和重要性出现在20世纪80年代,当时标志性研究将ATP依赖性底物泛素化与底物26S蛋白酶体的降解联系起来[4]。35年后,很明显泛素的这种功能只是一个巨大冰山的一角。
后基因组时代提供了对泛素系统复杂性的深入了解,远超过1000种蛋白质调控人类细胞中的泛素化[5]。泛素通过复杂的三步酶级联[6],利用E1泛素活化[7],E2泛素结合[8]和多种E3泛素连接酶[9-11]与底物连接。泛素化蛋白质是
由含有泛素结合结构域(UBDs)的受体识别[12],以及几个特殊的蛋白酶家族,去泛素化酶(DUBs)去除泛素修饰[13,14]。全面的蛋白质组学研究确定了数以千计的蛋白质上数以万计的泛素化位点[15-17]。结果显示大多数蛋白质在其细胞寿命的某个时间点会经历泛素化。
泛素化起始于单个泛素分子与底物Lys残基的连接。 这些单泛素化反应非常丰富[18],在细胞中有许多作用[19]。这篇综述重点介绍了当连接的单泛素进一步修饰时可能产生的大量信号。我们之前已经将泛素系统中的这种复杂性称为lsquo;泛素编码rsquo;[19],借用组蛋白修饰领域的命名法。lsquo;组蛋白编码rsquo;描述了组蛋白修饰的复杂相互作用,并且许多相互依赖的层次组装和分解规则已经在功能上被解析[20]。 正如下面将要讨论的,近年来对泛素编码的理解得到了迅速发展,然而,需要新的方法和见解来理解这些复杂的翻译后修饰代码。
泛素修饰 - 概念综述
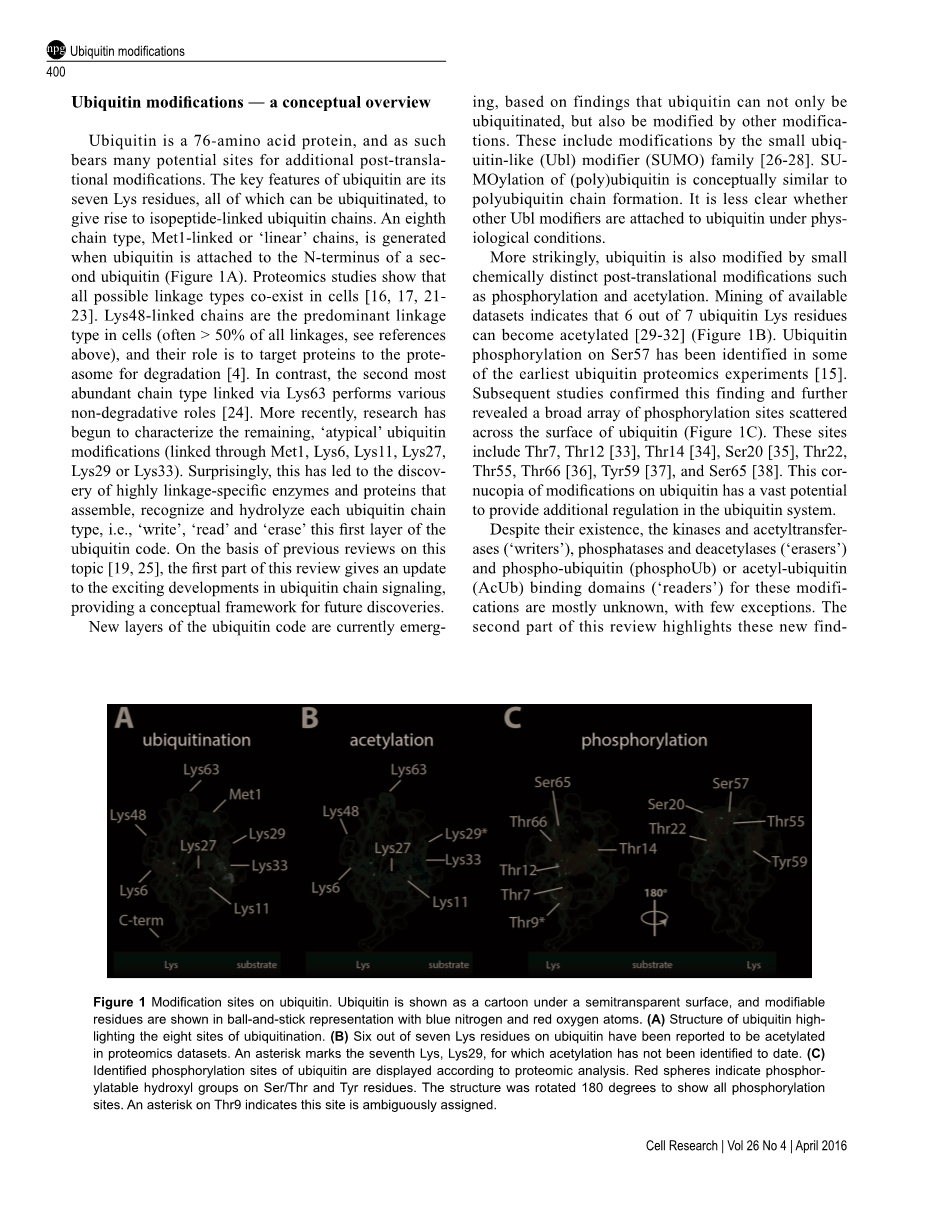
泛素蛋白是一种76个氨基酸的蛋白质,因此具有许多潜在的翻译后修饰位点。 泛素的关键特征是其7个赖氨酸残基,所有这些残基都可以被泛素化,从而产生异肽连接的泛素链。 当泛素连接到第二个泛素蛋白的N-末端时,产生第八链型Met1连接或“线性”链(图1A)。蛋白质组学研究表明,所有可能的连接类型在细胞中共存[16,17,21-23]。Lys48连接的链是细胞中主要的连接类型(通常大于所有连接的50%,见上文参考文献),其作用是标记靶向降解的蛋白质[4]。相反,通过Lys63连接的第二丰富的链类型执行各种非降解作用[24]。最近,研究开始表征其余的“非典型”泛素修饰(通过Met1,Lys6,Lys11,Lys27,Lys29或Lys33连接)。令人惊讶的是,这导致了高度连接特异性的酶和蛋白质的发现,它们组装,识别和水解每种泛素链类型,即lsquo;写rsquo;,lsquo;读rsquo;和lsquo;擦除rsquo;这第一层泛素密码。在此前关于该主题的综述[19,25]的基础上,本综述的第一部分对泛蛋白链信号传导的令人兴奋的发展进行了更新,为未来的发现提供了一个概念框架。泛素编码的新层目前是
新兴的
基于泛素不仅可以被泛素化的发现,而且还可以通过其他修饰来修改。这些包括小的类泛素(Ubl)修饰(SUMO)家族的修饰[26-28]。(多)泛素的SUMO化在概念上类似于多聚泛素蛋白链的形成。在生理条件下其他Ubl修饰物是否与泛素连接还不太清楚。
更引人注目的是,泛素也被小的化学上不同的翻译后修饰如磷酸化和乙酰化修饰。挖掘可用数据集表明7个泛素赖氨酸残基中有6个可以被乙酰化[29-32](图1B)。在最早的一些泛素蛋白质组学实验中已经确定了Ser57上的泛素磷酸化[15]。 随后的研究证实了这一发现,并进一步揭示了散布在泛素蛋白表面的大量磷酸化位点(图1C)。这些位点包括Thr7,Thr12 [33],Thr14 [34],Ser20 [35],Thr22,Thr55,Thr66 [36],Tyr59 [37]和Ser65 [38]。这种对泛素修饰的聚宝盆具有在泛素系统中提供额外调节的巨大潜力。
尽管存在这些修饰的激酶和乙酰转移酶(lsquo;writersrsquo;),磷酸酶和脱乙酰基酶(lsquo;erasersrsquo;)和磷酸泛素(phosphoUb)或乙酰泛素(AcUb)结合结构域(lsquo;readersrsquo;),除少数例外,它们的修饰仍然大部分是未知的。这篇综述的第二部分重点介绍了这些新的发现
图1 泛素的修饰位点。泛素在半透明表面上显示为卡通图形,并且可变残基以蓝色氮和红色氧原子的球状表示。(A)突出泛素化八个位点的泛素结构。(B)在蛋白质组学数据集中,据报道在泛素的七个赖氨酸残基中有六个被乙酰化。星号标记第七个Lys,Lys29,迄今尚未鉴定其乙酰化。(C)根据蛋白质组分析显示泛素的磷酸化位点。红色球体表示Ser / Thr和Tyr残基上可磷酸化的羟基。该结构旋转180度以显示所有磷酸化位点。 Thr9上的星号表示此位点被不明确地分配。
图2 泛素代码中的新复杂性。(A)一些可能的泛素 - Ubl(NEDD8,SUMO2 / 3)的概念性表示以及泛素的化学修饰。(B)未锚定的泛素和泛素链,无论有无修饰,都可以作为细胞中的第二信使。
涉及这些修饰,并且关注Ser65-phosphoUb及其在线粒体自噬和帕金激活中的作用。
显著扩展的代码
泛素修饰的新层显著改变泛素编码的前述特征[19]。蛋白质的单泛素化可以用直链或修饰的泛素发生,链可以是
同型(一种连接类型)或异型(图2A)。在后者中,一种连接类型的链可以延伸第二种类型,形成非分支结构。 或者,链中的泛素蛋白分子可以在多个Lys残基处泛素化,形成“分支”(也称为“分叉”)结构。 此时,我们必须假定所有的泛素部分,即使在复杂的拓扑结构中,都可以通过乙酰化或磷酸化或两者进一步修饰(图2A)。
考虑泛素之间的八种连接类型
分子,Ubls或乙酰基团对泛素赖氨酸残基的替代修饰以及11个潜在的磷酸化位点,这产生了基本无限数量的潜在组合。
不同的泛素信号可以附着在底物上,并引发底物特异性反应。 此外,“未锚定”的泛素或泛素链存在于细胞中,并发挥第二信使样功能[39-41]。 单泛素是细胞裂解物的主要成分,一旦被磷酸化或乙酰化,就可以作为新的信号分子,以第二信使样的方式(图2B)。 事实上,#39;游离#39;Ser65-phosphoUb可以在细胞中检测到[42],并且可以激活激酶信号传导[43](见下文)。 此外,未锚定的多聚泛素蛋白一旦被磷酸化后可能是DUB抗性的[44,45](见下文),并作为相对稳定的独立信号实体发挥功能。
研究泛素化事件
在这一点上,重要的是要简要地讨论可用于了解泛素修饰的工具,这些修饰近年来已经变得相当复杂(图3)。 新的生物化学方法利用特定链接的DUB [46]和UBD [47,48]。 针对Met1-,Lys11-,Lys48-和Lys63-连接链以及针对Ser65-phosphoUb的链接特异性抗体已经开发并提供了非常有用的试剂[42,49-51]。 尽管如此,质谱对于研究泛素密码具有最深远的影响[52]。 使用细胞(SILAC)和肽(TMT)标记以及使用标记的泛素肽标准品(AQUA)进行绝对定量的定量技术可以与富含泛素化肽的抗体结合使用,并且可以对泛素系统进行深入研究。 最近对深入研究质谱在研究泛素化中的作用进行了深入的研究[52]。
尽管如此,重要的是要意识到基于质谱的方法依赖于泛素的胰蛋白酶消化和深入分析产生的泛素肽。 虽然这可以使用正确的工具和工作流程对某些修改的相对量和绝对量进行注释和量化,但它会阻止深入理解修改之间的相互影响。 例如,处理“分支”泛素链的一个新领域,其中一个泛素分子在多个位点泛素化,由于无法研究所有内源支链而受到严重影响。 此外,似乎很可能某些泛素磷酸化事件仅存在于特定的多聚泛素蛋白链中。 它是这个
图3研究Ub修改。 连接特异性UBD [47,48],泛素链限制性(UbiCRest)分析[46],连锁特异性抗体[49-51],Ser65-phosphoUb抗体[42]和质谱[52]允许鉴定链类型和泛素修饰。 质谱可以定量样品中所有的泛素连接。 相对定量技术包括串联质量标签(TMT)标记和细胞培养中氨基酸稳定同位素标记(SILAC),而绝对定量(AQUA)策略确定每种泛素链类型的确切量[52]。 类似的策略可用于鉴定和量化泛素的小分子和Ubl修饰。
有关改进组蛋白领域的修改中的层次结构的信息,以及新的方法和工具对于获得对泛蛋白代码的相似程度的认识是必不可少的。
泛素链信号传导的新见解
尽管如此,可用的方法和工具已经为泛素信号传导提供了令人兴奋的新见解,并且在泛素系统的酶促机制和不同连接的多聚泛蛋白信号的功能方面取得了许多进展。 我们以前审查了非典型泛素链的作用[19,25],然而这个领域继续迅速发展。 下面,我们提供更新和讨论所有链类型的最新发展,以及泛素链结构的见解。 引人注目的是,最近的数据已经动摇了关于什么构成最小蛋白酶体靶向信号的长期教条,并且基于此,我们讨论了用于蛋白酶体降解的“泛素阈值”模型。
图4与个别链类型相关的生理角色。 (A)指出组装E2和E3酶的少量选择,以及拆分具有连锁偏好的泛素蛋白链的DUB。 下面,漫画说明了一些(新)生物过程,正如文中所讨论的,特定的连锁类型已经与之相关联。 (B)APC / C在早期有丝分裂过程中具有活性,并修饰细胞周期调节因子,例如带有Lys48 / Lys11连接的支化多聚泛素蛋白的Nek2A。 在这个过程中,UBE2C首先在底物上组装短链,然后这些被Lys11连接的聚合物在每个泛素上延伸。 Lys48 / Lys11支链增强蛋白酶体降解。 (C)混合或分支的Lys63 / Met1连接的链在免疫受体如IL-1受体中起到蛋白质支架的作用,以促进NF-kappa;B信号传导。 (D)病毒E3连接酶通过连接混合或分支的Lys11 / Lys63连接的泛素蛋白链来启动MHC I类受体的内吞内化。
Met1连接的#39;线性#39;泛素链
对Met1连接的“线性”泛素链的研究例证了特定链类型的研究如何促进生物学。 该领域从鉴定线性泛素链装配复合体(LUBAC)开始,其包括仅装配Met1连接的多聚泛素蛋白的RING-RING(RBR)家族HOIP的E3连接酶[53](图4A) 。 随后,NEMO(kappa;B激酶抑制剂(IKK)复合物的组分)中的Met1-连接特异性UBAN(泛素在ABIN和NEMO中的结合)结构域的鉴定,将Met1连接链与NF-kappa;B活化连接[ 54,55]。 实际上,LUBAC调节肿瘤坏死因子(TNF)和相关细胞因子的信号传导[56,57],并发现Met1连锁链附着于在其受体上组装的大复合物组分,如NEMO和RIPK1 [56,58] 。 事实上,我们现在了解LUBAC特异性在精细生化和结构细节[59-62]中的分子基础,以及几种小型UBD的Met1连接特异性泛素结合[55,63-65]。 此外,过多的遗传模型已证实LUBAC在炎症和免疫中的重要作用[58,66-72],并且LUBAC组分在人类炎症条件下也发生了突变或消除[73,74]。 Met1连接的泛素蛋白链的生理作用已被广泛审查[75,76]。
最初,还不清楚哪个DUB会对抗Met1连接的多聚泛素蛋白。 泛素特异性蛋白酶(USP)酶CYLD切割具有相似活性的Lys63和Met1连接的多聚泛素蛋白链[54,77]。 更令人惊讶的是,OTULIN(具有线性连接特异性的卵巢肿瘤(OTU)结构域DUB,也称为FAM105B或Gumby)可以显示完整的Met1连锁特异性[78,79](图4A)。 OTU-LIN使用泛素辅助催化机制,其中Met1连接的多聚泛素蛋白直接调节酶的催化中心[78]。 与Met1连锁链的作用一致,OTULIN可以调节NF-kappa;B信号传导[78,80-82],但有趣的是,OTULIN也影响Wnt信号传导[79,83]。 Met1连锁链在此途径中的作用尚未被描述,并且需要进一步研究。 从机制上讲,CYLD和OTULIN通过与LUBAC直接相互作用来调节Met1连接的链,两者的结合与催化亚基HOIP的N-末端PUB结构域互相排斥[81-84]。 另一种OTU DUB,A20通过不同的途径抑制NF-kappa;B信号传导。 A20通过C端#39;A20样ZnF#39;结构域结合Met1连接的链[64,65],但其N端OTU结构域不能水解这种连接类型[85],并且A20的DUB功能的相关性具有被质疑[86]。 最近的工作表
全文共43380字,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[17346],资料为PDF文档或Word文档,PDF文档可免费转换为Word
以上是毕业论文外文翻译,课题毕业论文、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。
您可能感兴趣的文章
- 通过对奥美拉唑合成反应的监测和定量反应的在线拉曼光谱和表征组件外文翻译资料
- 无金属碳基催化剂的研究进展外文翻译资料
- 钼酸钙/碳三维复合材料可控设计合成的研究外文翻译资料
- 生物催化选择性合成功能化喹唑啉酮衍生物外文翻译资料
- 三元V Zr Al ON氧氮化物-3-甲基吡啶氨氧化的高效催化剂外文翻译资料
- 综述纳米零价铁(nZVI)的合成,特性和在环境修复中的应用外文翻译资料
- 自消毒PVC表面使用点击化学设计外文翻译资料
- 微波辅助直接合成4H-1,2,4-苯并噻二嗪1,1-二氧化物衍生品外文翻译资料
- 微波辅助下直接合成1,1-二氧代-4H-1,2,4-苯并噻二嗪类衍生物外文翻译资料
- 压力选择在变压精馏中的重要性外文翻译资料


