
英语原文共 11 页,剩余内容已隐藏,支付完成后下载完整资料
腐蚀科学
低碳钢在强酸性环境中腐蚀抑制剂2-((噻唑-2-亚氨基)甲基苯酚的电化学与理论研究。
摘要:用失重法、极化法、电化学阻抗谱和扫描电镜研究了2-((噻唑-2-亚氨基)甲基)甲基苯酚作为缓蚀剂对碳钢在2M HCl溶液中的缓蚀性能,对吸附机理进行了评价。同时测定了零电荷电位(Epzc)以评价吸附机理。用密度泛函理论(DFT)计算了B3LYP/6-31G(d,p)水平上的最高占用分子轨道能(EHOMO)、最低未占用分子轨道能(ELUMO)、能隙(△E)、偶极矩()等量子化学参数等,理论和实验结果吻合较好。
关键词:软钢缓蚀剂;EIS;极化;扫描电镜;可测试性设计。
一.引言
由于所用材料、环境和使用条件的综合作用,工业上普遍存在腐蚀问题。腐蚀可能不会立即对材料产生有害影响,但它会影响强度、机械操作和外观,从而导致严重的操作问题。
酸溶液广泛应用于钢铁酸洗、化学清洗、除垢、酸化等工业生产中,其中氯化氢是最常用的酸溶液之一。这些环境具有自然腐蚀性,导致工业过程中出现严重的腐蚀问题。酸腐蚀抑制剂在工业上的应用广泛用于防止或减少与酸接触时的材料损失。
在酸性溶液中,腐蚀的阳极反应是金属离子从金属表面进入溶液(无材料)的过程,而阴极反应是氢离子产生氢气或还原氧气的过程。保护金属不受腐蚀的一种方法是加入某种有机分子倾向于吸附在表面形成保护层。缓蚀剂可通过单独降低阳极或阴极反应速率或同时降低阳极和阴极反应速率来降低金属的腐蚀速率,缓蚀剂则分别称为阳极、阴极或混合型缓蚀剂。有机分子的缓蚀作用可能随实验条件的改变而改变,如酸的阴离子浓度、ph值和金属的性质。此外,吸附还取决于抑制剂分子的某些物理化学性质,如官能团、立体因子、芳香性、供体原子的电子密度和供体电子的轨道性质,以及抑制剂的电子结构。金属在酸性溶液中的腐蚀可被含有杂原子官能团的有机化合物(即氮、磷、氧、硫)所抑制。这些具有自由电子对的杂原子起亲核作用,在n电子和金属表面之间形成键。另一方面,含有多个键的有机化合物是更有效的抑制剂,因此,在系统中引入多个键在理论上应该会提高大多数有机化合物的抑制效率。当这两种特性结合时,可观察到增强的抑制作用。
软钢由于其可用性、物理性能和成本,是工业上最好的首选材料之一。盐酸是常用于化学清洗的溶剂。用于防止碳钢变质的一种高效缓蚀剂是由氮、硫和/或氧原子组成的杂环有机化合物。据报道,席夫碱类化合物是乳钢酸性介质中的有效抑制剂。三唑类和噻唑类化合物因其优异的缓蚀性能而引起人们的广泛关注。合成了一些新的三唑衍生物,研究了它们作为金属在酸性溶液中的缓蚀剂。特别是,这些化合物的席夫碱衍生物具有较高的抑制效率,这是由于骨架中的甲亚胺基(-C=N-)具有更高的抑制效率。
腐蚀测量采用多种技术来确定环境的腐蚀程度以及金属损失的速率。采用失重法和极化法对金属的腐蚀速率和缓蚀剂的缓蚀效果进行了评价。扫描电子显微镜(SEM)提供了金属表面的极好的二维视图。
量子化学研究是研究抑制效率与分子结构之间关系的最有效方法之一。因此,量子化学参数的计算,例如最高占据分子轨道(EHOMO)、最低未占据分子轨道(ELUMO)、能隙()和分子偶极矩的能量,是非常重要的。
采用失重法、极化法、阻抗法和扫描电镜(SEM)等实验技术,结合理论计算,研究了低碳钢在303k的2 M Hcl溶液中在2-((噻唑-2-亚氨基)甲基苯酚(THYMP)存在下的腐蚀行为。此外,本研究旨在通过测定Epzc并测试几个等温线的相关性来描述化合物的吸附行为。
二.实验部分
低碳钢的成分(wt%)C:0.01,P:0.03,S:0.03 Mn:0.85,Si:微量,Fe:99.08用于失重和电化学试验。在进行所有测量之前,使用800、1200和2400号金刚砂纸和金刚石浆糊,通过研磨和抛光至镜面,对碳钢进行表面预处理。低碳钢浸泡在乙醇中。用双蒸馏水清洗,最后干燥后称重。
以2-氨基噻唑(0.01m)和水杨醛(0.01m)在50ml甲醇中的缩合反应为原料,在室温下合成了2-((噻唑-2-亚氨基)甲基苯酚(THYMP)。将混合物加热至约75℃持续3小时,然后将所得混合物蒸发至其体积的一半,并使其停留24小时。然后将深橙色沉淀物过滤洗涤并重结晶(产率71%)。纯化后,用红外光谱和核磁共振对化合物进行了表征。图1显示了合成化合物的化学结构。
通过在双蒸馏水中稀释分析级37%HCl制备攻击溶液(2 M HCl)。为了保证溶解度,在10:1水乙醇比的混合物中制备了抑制剂化合物的储备溶液。缓蚀剂溶液的浓度分别为1x10-5,5x10-4,1x10-4,5times;10-3,1x 10-3,5times;10-2和1x 10-2M
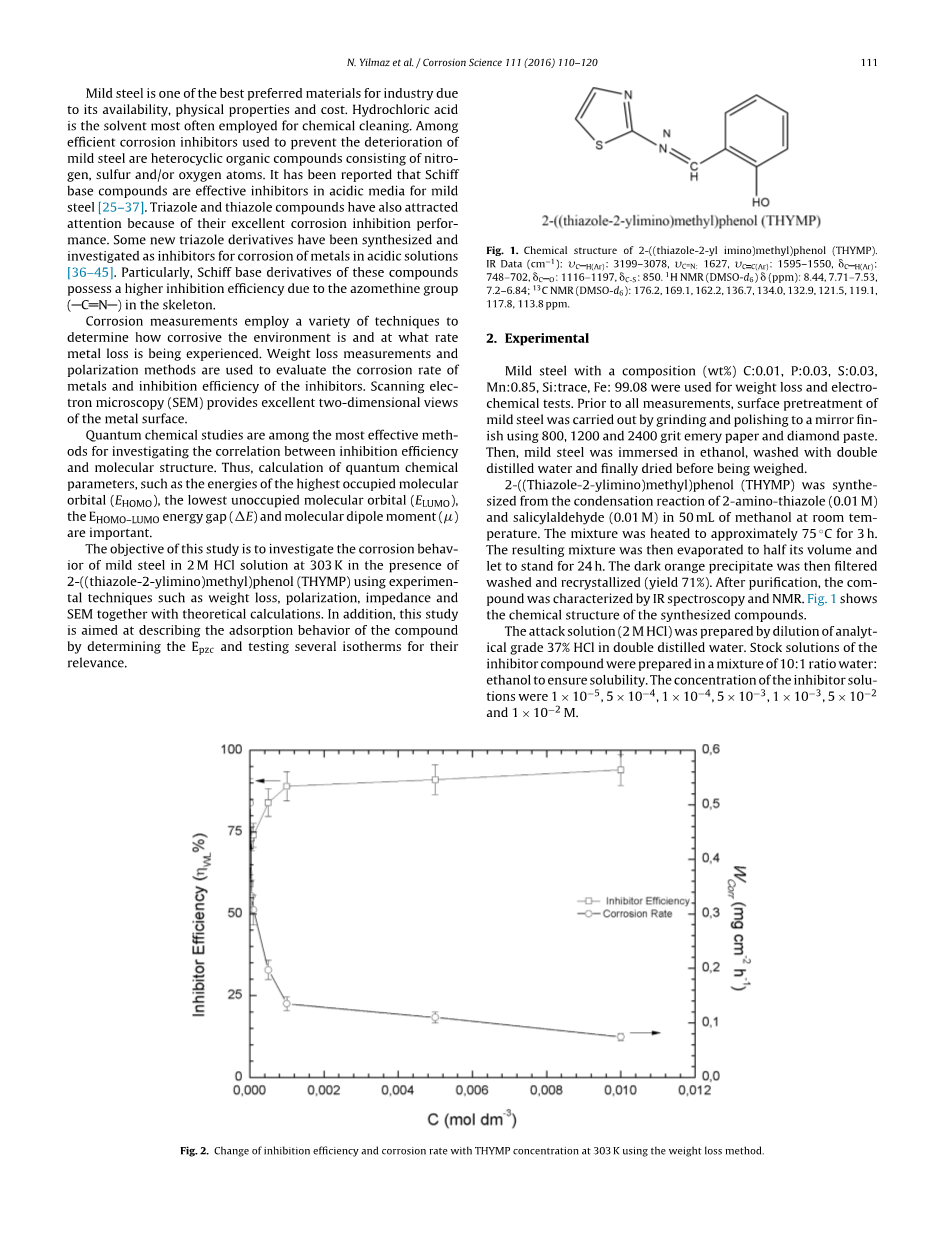
图2。失重法测定甲基苯酚在303k时的缓蚀效率和腐蚀速率的变化
在恒温恒温器中放置100ml容器进行了失重实验。样品尺寸为1.0 cm x 1.0 cm x 0.05 cm,一式三份,在含有不同浓度研究抑制剂的(303plusmn;1)K的2 M HCl溶液中浸泡24小时。然后,根据标准ASTM G1(制备、清洁和评估腐蚀试样的标准操作规程),去除试样,仔细脱脂,用双蒸馏水清洗,并准备称重。重量损失的平均值用于计算。
在总体积为100cm3的热套常规三电极Pyrex电池中进行。分别用铂片和饱和甘汞作为辅助电极和参考电极。为了制备工作电极,在环氧树脂中嵌入一根相同成分的钢棒,使其几何表面积仅为0.5cm2,用GAMRY PCI4-750仪器和相应的电化学软件进行了测量.
在扫描速度为1 mV/s的条件下,在-075V和-035V之间获得了动态极化曲线。电极在试验环境中放置30分钟后,再进行一次实验,证明了电极电位曲线足以达到可靠的稳定值。
为了确定极化电阻Rp,工作电极电位在扫描速率为0时在Eocp附近倾斜plusmn;10mv。在0.1~20khz的频率范围内,通过施加5mv峰值的交流电位信号,在开路电位下进行了电位-电流-线选择化学阻抗谱实验。将电极浸入试验溶液中30分钟,以获得稳定可靠的恒电位Eoep值。
所有电化学实验均在(303plusmn;1)K的非固定条件下在充气溶液中进行。在相同条件下,每次电化学测量重复三次以确保可靠性。软钢样品在无缓蚀剂的腐蚀溶液中浸泡24小时的表面形貌分析了(303plusmn;1)K时10-2M胸腺的变化。用FEI-Quanta-FEG 250扫描电子显微镜获得SEM图像。
用密度泛函理论(DFT)和Beckes三参数交换函数以及Gaussian 03程序包46实现的Lee-yang-parr非局部相关函数(B3LYP)对所研究的模型进行了完全几何优化。确定了最高占用分子轨道和最低未占用分子轨道(EHOMO和ELUMO)的能量、能隙()、偶极矩()、整体硬度()和柔软度()和电转移率()等理论参数。
三.结果与讨论
3.1重量损失
通过重量损失测量得到的缓蚀效率值(nwl%)和腐蚀速率值wcorr由下式计算得出:
式中,wcorr和wrsquo;corr分别表示无抑制剂和存在抑制剂时的腐蚀速率。表示三个实验中软钢样品的平均重量损失,A表示样品表面积,t表示时间。
图2显示了在303 K下浸泡24小时后,抑制剂浓度对抑制剂效率(nwl%)和腐蚀速率的影响。测量显示,甲基苯酚通过减少重量损失来抑制钢样品的腐蚀。抑制效率随添加剂浓度的增加而增加,在10-2M时胸腺的抑制效率达到最大值94%。
图3。在不同浓度的2-((噻唑-2-亚氨基)甲基)苯酚(甲基苯酚)存在和不存在下,钢在2 M HCl中的303 K极化曲线。
3.2极化测量
图3显示了在没有和存在不同浓度胸腺电化学腐蚀参数(如腐蚀电位(Ecorr)、阳极和阴极Tafel斜率(Ba和Bc)、腐蚀电流密度(icorr)的情况下,软钢在2 mhc中溶解的Tafel曲线,表中给出了表面覆盖度()和抑制效率百分比(Npo1%),和的值由以下公式计算得出
这里,icorr和irsquo;corr分别是缓蚀剂存在和存在时的腐蚀电流密度,这是通过线性外推阳极线和阴极线在150 mv点处比腐蚀电位(Ecorr)更正和更负来确定的 。胸腺的存在降低了阳极和阴极的密度。随着缓蚀剂浓度的增加,由于低碳钢表面活性中心的堵塞,腐蚀电流也降低。Tafel斜率表明,在百里香存在下,阳极反应和阴极反应都受到轻微影响,阳极反应受Bc变化的影响更大。
百里香对极化曲线的节点和阴极都有抑制作用,使阳极和阴极曲线向低电流密度方向移动,。这一结果表明,合成化合物的加入降低了阳极溶解并延缓了氢的析出反应(表1)。此外,该化合物的加入在Ecorr值上产生一个小的正位移,即低于 85 mv,表明胸腺作为一种混合型抑制剂,主要抑制阳极反应。
3.3极化电阻测量
极化电阻由电位线和电流线的斜率决定,
式中A是电极的表面积。利用Rp值计算抑制率,,使用关系式
其中Rp和Rrsquo;p分别是有机添加剂存在和不存在时的极化电阻。结果如表1所示,随着抑制剂浓度的增加,在甲基苯酚存在下的极化电阻增大,表明抑制剂在金属表面的吸附阻碍了活性中心的形成。
3.4电化学阻抗测量
电化学阻抗测量(EIS)用于测定金属/溶液界面在有胸腺存在和有胸腺存在时的行为。奈奎斯特曲线在估计阻抗参数方面非常有用。图4显示了在存在和存在胸腺的2 M HCl中软钢的奈奎斯特曲线。结果表明,缓蚀剂分子的加入明显改变了低碳钢在腐蚀溶液中的阻抗响应,阻抗谱显示出与腐蚀过程中电荷转移有关的单一凹陷电容性电位。电容环的直径随着添加剂浓度的增加而增大
可以观察到阻抗环并不像EIS理论所期望的那样产生完美的半圆。由于分散效应和缓蚀剂的吸附,环的中心位于实轴之下。在实际系统中得到的曲线代表了金属/溶液界面上的双层不作为实际电容器的一般行为。这种反常行为通常被认为是由于固体表面的不规则性和非均匀性引起的频率色散。当电极表面不均匀或粗糙,因几何因素而形成阻抗图。另一方面,由于接触两相之间的电荷分离,金属/溶液界面不能表现为真正的电容器。众所周知,在实际的电容器中,两个极板上的电荷分布都是由电子控制的。然而,考虑到金属/溶液界面,电子控制双层金属侧的电荷分布,而溶液侧则由离子控制,因为离子往往比平行于金属表面电荷的电不等价离子大得多,双层溶液侧的体积更大。
用于模拟EIS结果的相关等效电路模型如图5所示,电路的元件可以命名为:Rs为溶液电阻,Rp为极化电阻,CPE(Q)为定相元件,即双层电容。钢的总极化电阻必须等于Rct、电荷转移电阻和Rd、扩散层电阻、Ra、累积物种电阻(腐蚀产物、离子、抑制剂分子等)的总和。CPE的阻抗由表达式表示:
式中,Yo是比例因子;是角频率:j2=-1是虚数,n是CPE指数。凹陷的半圆表示需要更详细的模型来描述过程。因此,用恒定相位元件CPE代替理想电容元件,使之更精确地适合于说明半电容的凹陷性质CPE是一个广义元件,其特性取决于n CPE的值,CPE可以是电阻器(n=0)、电容器(n=1)、瓦伯格阻抗(n=0.5)或电感(n=-1)。由EIS数据得到的极化电阻Rp、CPE、n值等拟合结果见表2。
如表2所示,Rp值随添加剂浓度的增加而增加。这种增加可归因于金属/溶液界面上保护层的形成,但当Rp值增加时,CPE随缓蚀剂浓度的增加而减小,这可归因于双电层厚度的增加。带电金属表面和溶液之间的双层可以看作是一个电容器。化合物的吸附通过置换最初吸附在表面上的水分子和其他离子来增加金属/溶液的电容。此外,随着添加剂浓度的增加,该容量的降低可归因于在电极表面上形成保护层。随着缓蚀剂浓度的增加,保护层厚度增加。根据EIS结果计算的抑制效率与LSV测量结果显示的趋势相同
3.5浸泡时间的影响
研究了浸泡时间对添加10-2M百里香的2M HCL中乳钢的腐蚀行为的影响,为了在时间尺度上评估缓蚀剂行为的稳定性,记录了从12h到96h(4天)的阻抗谱。根据极化电阻值计算抑制效率,并根据时间绘制图表,如图6所示。该图显示,即使在96小时后,胸腺仍保持其92%的抑制能力。有趣的是,在接触抑制剂化合物的最初几个小时内,观察到极化电阻可能增加(最初10小时)表明缓慢的表面固定过程和缓慢重排的有机化合物导致更多的保护层(化学吸附)约12小时后,过程相反,显示抑制剂效率降低。24小时后抑制作用的降低可能是由于溶液中有效抑制剂分子的消耗。
3.6吸附等温线
如前所述,抑制作用是随着抑制剂在金属表面的吸附而产生的,保护程度与覆盖度有关。吸附等温线将缓蚀剂在溶液中的浓度与表面的缓蚀剂用量联系起来。吸附等温线可以提供胸腺与乳钢表面相互作用的重要信息。可以用来显示抑制剂分子吸附行为的两种相互作用是化学吸附和/或物理吸附。该方法依赖于化学结构、电化学电位、乳钢表面的电荷和性质。
所测缓蚀剂的实验数据符合不同的吸附等温线方程。所有实验结果与Langmuir吸附法吻合较好。利用Langmuir等温线获得最佳拟合,如图7所示。Langmuir等温线指出,覆盖度与公式中给出的浓度有关;
这里是被抑制剂覆盖的表面分数(覆盖度),Cinh是抑制剂浓度,ka
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[255311],资料为PDF文档或Word文档,PDF文档可免费转换为Word
以上是毕业论文外文翻译,课题毕业论文、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。
您可能感兴趣的文章
- 比利牛斯高山植被植物性状格局外文翻译资料
- 城市街景的整合为全面量化城市绿地生态景观提供了可能性——以西安市为例外文翻译资料
- 城市街景的整合为全面量化城市绿地生态景观提供了可能性——以西安市为例外文翻译资料
- 纳米金在NaBH4催化还原对硝基苯酚中的尺寸效应外文翻译资料
- 矿物成分在生物炭生产、性能和应用中的重要性外文翻译资料
- 纳米锰氧化物改性生物炭通过氧化辅助吸附过程从水中有效去除鳌合柠檬酸铜外文翻译资料
- 海洋中的塑料和微塑料:从新出现的污染物到新出现的威胁外文翻译资料
- PARP1对DNA损伤的NAD 消耗引发了对受损细胞存活至关重要的代谢转移外文翻译资料
- 多不饱和脂肪酸和复发性情绪障碍:现象、机制和临床应用外文翻译资料
- 中国成年居民饮食相关知识、态度、行为与自评健康的关系:一项基于人群的研究外文翻译资料


