
英语原文共 7 页,剩余内容已隐藏,支付完成后下载完整资料
使用实验设计评估壳聚糖/海藻酸钠珠粒:配方和体外表征
摘要:牛血清白蛋白加载珠通过海藻酸钠与氯化钙和壳聚糖的离子胶凝制备,研究了海藻酸钠浓度和壳聚糖浓度对粒径和加载效率的影响,形成的珠的直径取决于所用针的大小,制备海藻酸钠-壳聚糖珠粒的最佳条件为pH=5,藻酸盐浓度为3%,壳聚糖浓度为0.25%。所得的珠粒制剂具有98.5%的加载效率和1,501mu;m的平均尺寸,并且扫描电子显微镜图像显示球形和光滑颗粒。壳聚糖浓度显着影响壳聚糖-海藻酸钠珠的粒径和包封率(p lt;0.05)。 降低海藻酸钠浓度导致酸性介质中白蛋白的释放增加。壳聚糖-海藻酸钠基质在较高pH下的快速溶解导致蛋白质药物的突释。
关键词:海藻酸钠;壳聚糖; 药物释放; 封装效率; 粒度。
引言
近年来,制药科学家在胃肠道(GI)中提供特定位点递送的靶向机制的数量显着增加(1)。对药物输送系统的特定地点和时间控制的研究正在为开发新的和/或改进的药物治疗带来重大推动力。通常,将药物靶向到胃肠道内的特定部位是非常有益的,以达到最大化治疗反应或减少药物递送到了肠道的不合适区域而引起的副作用(1,2)。用于生物活性物质如蛋白质,肽和酶的递送制剂的开发已被认为是临床医学中成功治疗效果的最重要基础之一,因为肽和蛋白质药物的口服给药需要它们免受胃中的降解环境及其在肠道吸收的改善(1,3)。
在通过口服递送肽或蛋白质药物的设计中,具有pH敏感性的水凝胶如海藻酸钠和壳聚糖(CS)已经引起越来越多的关注,因为大多数的合成聚合物都具有免疫原性,并且将蛋白质掺入这些聚合物需要恶劣的环境,可能会使所需的蛋白质变性和失活(4)。海藻酸钠和壳聚糖是天然的聚合物,它们具有生物相容性,可生物降解性,并且给药没有全身毒性。海藻酸钠是由alpha;-L-古洛糖醛酸(G)和beta;-D-甘露糖醛酸(M)残基组成的多糖家族, 以每种类型的均聚块(MM,GG)和杂聚块(MG)排列。海藻酸钠与聚阳离子形成强力复合物,在聚乙二醇中更具抗药性,钙螯合剂的存在,可用于稳定凝胶并降低其孔隙度(4-7)。在这些聚阳离子中,CS因其安全性和粘膜粘附性而受到相当的关注(8,9)。由于其亲水性和阳离子特性,壳聚糖具有在与抗衡阴离子接触时凝胶化的能力。 据报道,壳聚糖的氨基能够通过离子结合与具有羧基的阴离子聚合物(例如羧甲基纤维素或海藻酸钠)相互作用(10-13)。海藻酸钠 - 壳聚糖复合物可以在口服蛋白质递送系统中有重要用途。海藻酸钠具有在低pH下收缩并在较高pH下溶解的特性,而壳聚糖在低pH下溶解并且不溶于较高pH范围(4)。
在这方面,已经提出使用通过添加钙离子凝胶化的海藻酸钠来制备珠粒。温和的包封方法可以提高蛋白质稳定性并保持包封材料的生物活性。 此外,珠粒可以在蛋白质通过胃的酸性和酶促环境时保护蛋白质,并且一旦蛋白质到达小肠区域就可以通过扩散的方式和胶囊降解来释放蛋白质,在小肠区域蛋白质被有效地吸收到血流中(10,13)。 在封装方法中,珠粒的粒径显示主要受海藻酸钠与壳聚糖的比例,生物聚合物的分子量和溶液pH(11)的影响。
在这些考虑的基础上,本研究的目的是评估两种带相反电荷的亲水天然聚合物(壳聚糖和海藻酸钠)对保留模型蛋白,牛血清白蛋白(BSA)和在制造期间珠粒的粒度。为了减少BSA在吸收前的潜在降解,在小肠pH值下的控制释放的实现也是一个目标。虽然使用海藻酸钠和壳聚糖聚合物的蛋白质递送有不同的胶体装置(4,10,12,14),到目前为止,只有少数尝试将配方变量与最终珠子特性进行统计学关联。因此,在这项工作中,使用中心复合设计来同时研究壳聚糖 - 海藻酸盐递送系统的两个配方变量对两个响应变量的影响。中央复合设计(CCD)和响应面分析被使用,因为它们是系统和有效的方法来研究多个变量的影响并找到一个最佳配方(16)。
材料和方法
材料
海藻酸钠(Primal-LF 120 M)是来自FMC生物聚合物(美国)的礼物。用旋转粘度计(Brookfield,USA)测量20℃下1%(w / w)的海藻酸钠水溶液的粘度为720cps。
壳聚糖H是来自Dainichiseika Color&Chem.Mfg的礼物。(日本)。牛血清白蛋白是来自Amresco 化学品公司(美国)。氯化钙,氢氧化钠和乙酸是从Sigma-Aldrich(德国)获得。所有化学品的规格都是分析级的。
方法
实验设计
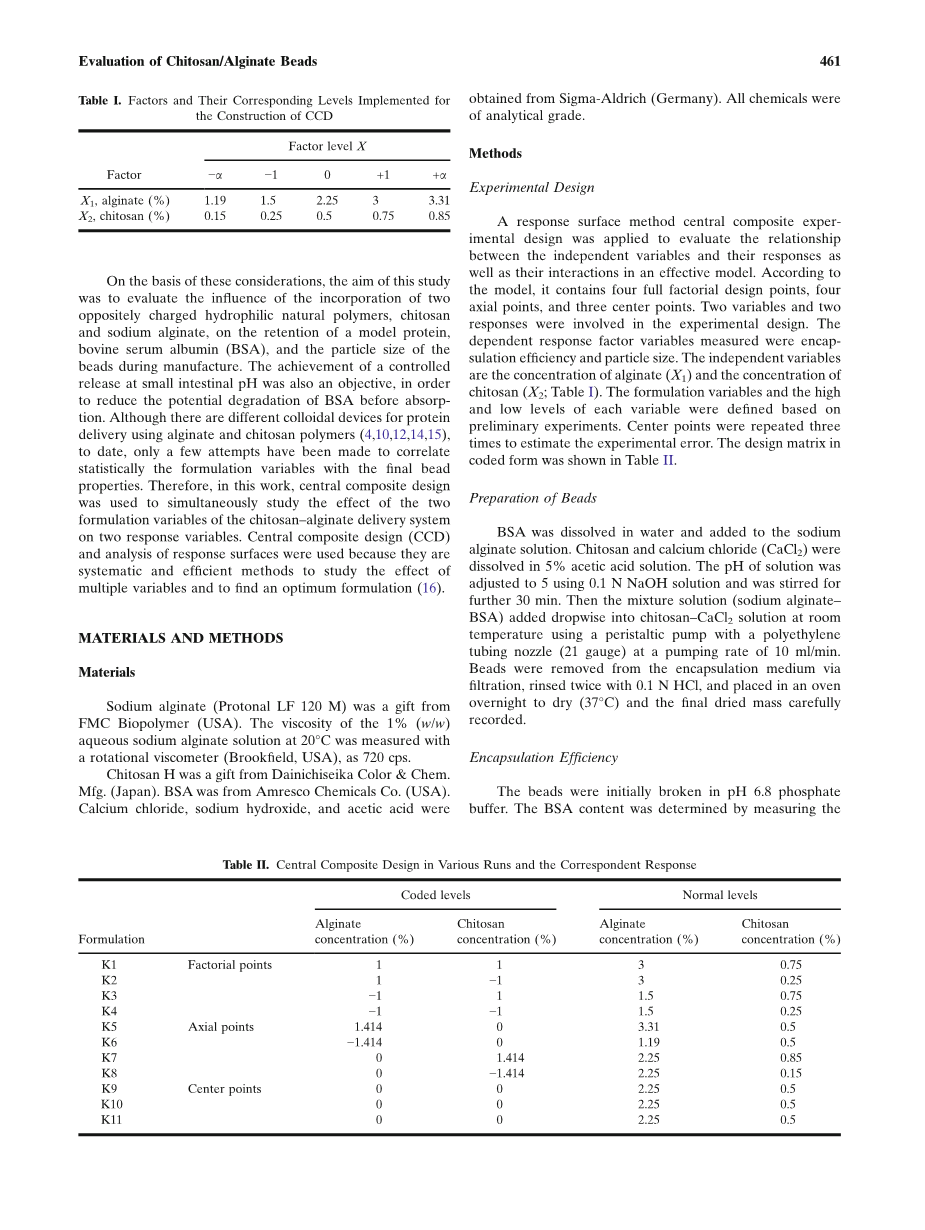
采用响应面法-中心复合实验设计方法,对一个有效模型中的自变量及其相互作用及其相互作用进行评价。 根据这个模型,它包含四个完整因子设计点,四个轴向点和三个中心点。 实验设计中涉及两个变量和两个响应。 测量的相关响应因子变量是封装效率和粒度。 自变量是海藻酸钠的浓度(X1)和壳聚糖的浓度(X2;表I)。 根据初步实验确定每个变量的公式变量和高低水平。 中心点重复三次以估计实验误差。 编码形式的设计矩阵如表2所示。
珠粒的制备
将牛血清白蛋白溶解于水中并加入到海藻酸钠溶液中。 将壳聚糖和氯化钙(CaCl 2)溶于5%的乙酸溶液中。 使用0.1N NaOH溶液将溶液的pH调节至5并再搅拌30分钟。 然后使用具有聚乙烯管喷嘴(21标准)的蠕动泵以10ml / min的泵送速率将混合物溶液(海藻酸钠-牛血清白蛋白)滴加到壳聚糖-CaCl 2溶液中。从封装介质中通过过滤除去珠粒,用0.1N HCl冲洗两次,放入烘箱中放置过夜干燥(37℃),并仔细记录最终的干燥物质。
封装效率
珠子最初在pH6.8的磷酸盐缓冲液中破碎。 通过用紫外分光光度计测量740nm处的吸光度来确定牛血清白蛋白含量。 Lowry方法用于蛋白质的测定(17)。牛血清白蛋白在壳聚糖 - 藻酸盐珠粒中的包封率通过公式1计算。
其中LA是实际负载,LT是珠中牛血清白蛋白的理论负载量(重量百分比)。 封装效率结果列于表III。
粒度分析
使用激光散射粒度分布分析仪(Sympatec GmbH,德国)测定粒度分析。 粒度结果列于表III中。
统计分析
数据评估使用逐步多元线性回归分析完成。 模型预测公式分别为每个因变量估计。 由三级实验设计产生的预测方程的一般类型是等式(2)所示的二阶多项式2
其中y是相关变量,b0是常数,b1,...,b5是回归系数。 X1和X2是独立变量,X1X2是交互项,表明当两个因素同时变化时响应如何变化。 X12和X22是独立变量的二次项来评估非线性。 在最终的模型方程中,只有重要因素被包括在内。
通过回归模型和绘制响应曲面图的统计分析数据通过NCSS(Kaysville,UT,USA)实现。 使用方差分析(ANOVA)对开发的模型进行重要性检验。 所有测试均以95%的显着性水平进行(alpha;= 0.05)。
从珠粒中释放蛋白质的评估
称量的珠子悬浮在pH 1.2的胃液培养基中。 该培养基在实验室摇床中以140rpm搅拌并在水浴中保持在37plusmn;0.1℃。 在0.1N HCl中测试海藻酸钠凝胶珠粒的药物释放2小时,因为平均胃排空时间为约2小时。 然后用pH6.8的磷酸盐缓冲液代替溶出介质并测试药物释放3小时。 以适当的时间间隔从两种培养基中取样,并用分光光度法分析牛血清白蛋白的量。
扫描电子显微镜
在真空下用金涂覆凝胶珠5分钟。 使用扫描电子显微镜(JSM-840A,Joel Ltd.,Japan)在11kV下进行凝胶珠的形态学检查。
结果与讨论
粒度
如图1所示,壳聚糖/海藻酸盐珠粒显示出球形和粗糙的聚合物基质.11种制剂的平均粒径在1478和1588mu;m之间(图2)。 发现每种制剂的粒度分布在很窄的范围内(图3),但平均粒度在制剂中略有不同。 因此,可以得出结论,聚乙烯管道喷嘴(21规格)是导致形成更大颗粒尺寸的重要参数。 通常,直径大于1.00mm的珠可以通过使用具有针或移液管的注射器(5)来制备。 Hari等人 (14)也报道,当海藻酸钠溶液通过针头(0.15mm直径)滴下时,从塑料注射器进入含有CaCl 2溶液的烧杯中珠尺寸为约900-1,000mu;m。
体外药物释放
图4,5和6说明了中央复合设计的四个阶乘,四个轴向和三个中心点的释放曲线。 从几种制剂的珠子中释放BSA的曲线显示在胃介质中2小时,然后在pH 6.8磷酸盐缓冲液中3小时。 从图4可以清楚地看出,这些制剂表现出类似的药物释放。 在胃介质中K1和K2制剂2小时未见药物释放; 然而,在模拟胃液中测试2小时后,从制剂K3和K4释放的累积平均百分比牛血清白蛋白分别为5.86plusmn;3.2和6.73plusmn;3.9。
K3和K4制剂中胃液中的药物释放可能是由于珠中藻酸钠含量降低所致。在模拟胃介质中释放少于7%的牛血清白蛋白表明海藻酸钠 - 壳聚糖复合物能够最小化胃生理环境中的药物释放。在低pH值下,藻酸盐不会膨胀,但发生收缩逆转并且内容物不释放(4)。用pH6.8的磷酸盐缓冲液代替溶出介质后,所有制剂显示突释,并且在pH6.8的测试1小时结束时,发现从制剂K1,K2,K3和K4释放的累积平均百分比药物为分别为100plusmn;4.2,90.6plusmn;3.3,99.8plusmn;4.2和104.7plusmn;3.8。在聚合物基质体系中,药物以速率控制的方式均匀分散。当这样的系统暴露于溶出介质时,药物释放通过基质膨胀和基质周边溶解/侵蚀扩散来调节(6,18)。
图5表示轴向点5小时牛血清白蛋白释放的百分比。 按照中心复合设计,配方K5和K8含有最高的海藻酸钠载量(alpha;= 1.14),在2.5小时时分别显示出65.7plusmn;4.5%和51.4plusmn;3.8%。 轴心点的结果表明海藻酸钠浓度对强复合的显着影响。 这一现象与之前的研究结果一致,据报道,低浓度藻酸盐制备珠粒的释放速度较快,但高浓度制备的珠粒释放速率较慢(19)。然而,封装在藻酸盐基质中的蛋白质在3 由于聚合物网络的降解。
为了计算建议的回归模型的拟合度不足,设计中包括了中心点以计算由于实验程序导致的纯粹误差。 从图6中我们可以得出结论,所有三个中心点的释放彼此重叠的事实表明,由于实验过程而产生的误差在为因变量产生有意义的拟合方面较少。
制备牛血清白蛋白负载珠的制剂和技术方法必须提供相对长时间的BSA释放控制或延迟胃内药物释放。这些预期基于聚合物的物理化学性质。先前已经表明,藻酸盐-壳聚糖复合物的结合和稳定性取决于藻酸盐凝胶的组成和珠粒的生产程序(4,15,20)。在一步法中,当藻酸盐溶液直接滴入氯化钙-壳聚糖溶液中时,在藻酸盐和壳聚糖溶液之间的界面处形成复合凝聚膜。如果珠粒是通过一步法制备的,则只有少量的壳聚糖结合。这可能是因为壳聚糖仅结合到表面上,形成具有这种小孔的膜,从而进一步将壳聚糖扩散到珠中并随后结合到凝胶网络上受到限制(20)。在我们的研究中,当将珠子转移到pH6.8的磷酸盐缓冲液中时,所有制剂均获得快速和完全的牛血清白蛋白释放。该结果可合理归因于珠粒的生产过程,其导致壳聚糖的低含量结合到表面上并由此导致聚合物基质的侵蚀。关于在小肠pH下实现更受控制地释放牛血清白蛋白,在该pH下防止藻酸盐 - 壳聚糖基质的侵蚀被认为是合意的。
配方变量对粒径的影响
表4以回归模型显示自变量对颗粒大小的影响。 与模型项一起,发现因子X2是显着的,与响应Y1有关的多项式方程可写为方程3。
随着壳聚糖浓度(X2)的增加,相应的粒径也增加。 可能的解释可能是由于藻酸钠的羧基与壳聚糖的氨基之间形成了聚电解质复合物。 发现壳聚糖与藻酸盐的最佳结合比约为1:1(21)。 道格拉斯和Tabrizian(11)也报道说,当官能团的可用性处于化学计量比时,形成较小的颗粒。 增加壳聚糖或藻酸盐的相对量导致粒径增加。
pH值的影响也是颗粒大小的重要参数。大部分水溶性差的壳聚糖在添加到pH为7.1的藻酸盐溶液中时可能沉淀,且大部分胺基未去质子化,因此不能参与离子相互作用。少数可用于相互作用的质子化基团会导致与藻酸盐凝胶的静电相互作用减弱,从而导致较大的粒径(11,22)。图7表示观察到的响应值与预测值的比较。图8中的响应曲线图清楚地说明了X1和X2之间的相互作用对粒径的影响。所研究范围内海藻酸盐浓度的影响没有统计学意义。这可能归因于生产方法中使用的针的大小。在所研究的藻酸盐浓度范围内,较大直径的针不受影响。我们可以得出结论,发现针的直径比藻酸盐/壳聚糖比率更有效地确定珠子的粒度。
配方变量对封装效率的影响
发现Y2<!-- 全文共10132字,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[16635],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 播撒生物炭促进鸟粪石形成,但加速重金属积累外文翻译资料
- 钢铁工业余热有机朗肯发电的能量及炯分析外文翻译资料
- 深度共晶溶剂微波辅助处理木质素-碳水化合物复合 物的高效裂解及超快提取木质素低聚物外文翻译资料
- 功能化杯状芳烃离子团族[4]的合成、晶体结构及竞争结合性能外文翻译资料
- 面向高能量密度柔性超级电容器的无纺布用黑磷杂化微纤维的微流控纺丝结构外文翻译资料
- 活性炭对水溶液中氨的吸附外文翻译资料
- 制备可控海胆状NiCo2S4微球协同硫掺杂石墨烯作为高性能 二次锌空气电池的双功能催化剂外文翻译资料
- 钛酸盐材料对重金属离子的吸附外文翻译资料
- CO2敏感催化剂的合成与表征温度响应催化聚离子液体微凝胶外文翻译资料
- 温度响应微凝胶薄膜在湿环境中作为可逆二氧化碳吸收剂外文翻译资料


