
英语原文共 7 页,剩余内容已隐藏,支付完成后下载完整资料
界定红球菌SQ13-酮类固醇9alpha;-羟化酶活性包括末端加氧酶同源物KshA2活性与氧化还原酶组分KshB
在此之前我们已经界定了3-酮类固醇9alpha;-羟化酶(KSH),它是红细胞红球菌菌株SQ1中微生物类固醇降解的关键酶,是一种双组分铁硫单加氧酶,由末端加氧酶组分KshA1和加氧酶还原酶组分组成。KshB缺失kshA1基因导致突变菌株RG2在类固醇底物4-雄甾烯-3,17-二酮(AD)上生长的能力丧失。在这里,我们指出了一个密切的KshA1同源物,即菌株SQ1的KshA2的特征,在氨基酸水平上共享60%的同一性。突变菌株RG2中kshA2基因的表达恢复了AD和ADD的生长,表明kshA2也编码KSH活性。功能互补显示取决于kshB的存在。转录分析表明,在AD存在下,在亲本菌株红平红球菌SQ1中诱导kshA2的表达。然而,在启动子活动研究中,使用大肠杆菌的beta;-内酰胺酶作为红球菌的转录蛋白显示kshA2启动子实际上是在9alpha;-羟基-4-雄甾烯-3,17-二酮(9OHAD)或其代谢物存在下高度诱导的。通过未标记的基因缺失使亲本菌株SQ1中的kshA2失活不影响对9-OH-AD,胆固醇或胆酸的生长。我们推测KshA2在类固醇分解代谢过程中起着防止ADD毒性细胞内浓度积累的作用。在红平红球菌SQ1的kshA1 kshA2双基因缺失突变株中额外鉴定出第三个kshA同源物。用于kshA的开发的简并PCR引物可用于从其他(actino)细菌中分离kshA同源物。
红球菌属物种具有广泛的代谢能力,可以降解各种环境污染物,转化或合成化合物。红球菌的一个众所周知的特征是它们能够降解一系列天然存在的类固醇,包括胆固醇和植物甾醇,例如13-谷甾醇。
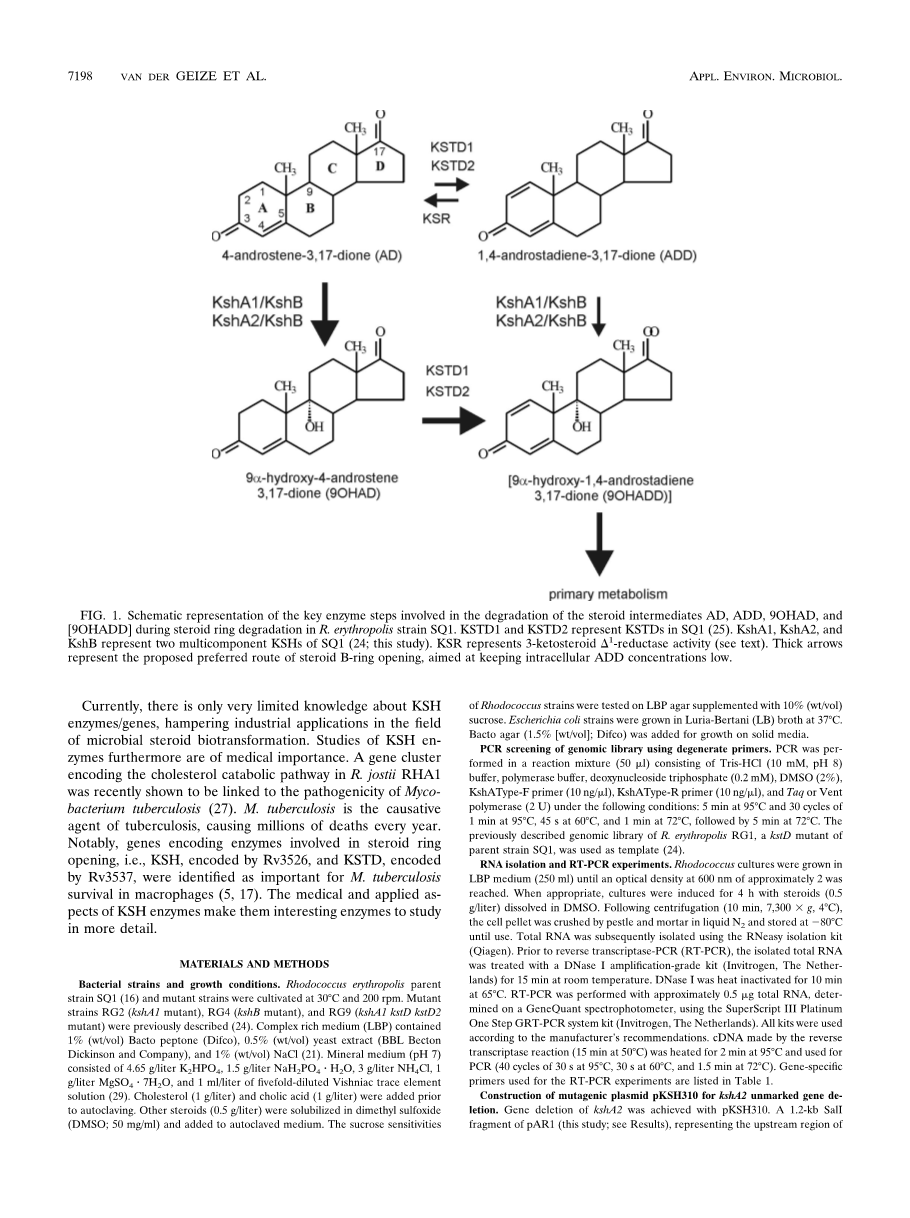
3-酮类固醇9alpha;-羟化酶(KSH)是微生物类固醇分解代谢途径中的关键酶促步骤,作用于4-雄甾烯-3,17-二酮(AD)或1,4-雄二烯-3,17-二酮(ADD) ) (图。1)。将9a-羟基部分引入类固醇多杂环结构中,与类固醇1 - 通过3-酮类固醇1 - 脱氢酶(KSTD)脱氢,由于化学形成而引发类固醇B-环开环不稳定的9alpha;-羟基-1,4-雄二烯-3,17-二酮(9OHADD)(图1)。赤藓红球菌SQ1的KSH是双组分IA类单加氧酶,由末端加氧酶KshA1和加氧酶还原酶组分KshB组成。非血红素加氧酶的分类基于组成成分的数量和它们的氧化还原中心的性质。根据定义,I类加氧酶是由还原酶组分和末端加氧酶组分组成的双组分酶。加氧酶的还原酶组分含有黄素单核苷酸(IA类)或黄素腺嘌呤二核苷酸(IB类),NAD结合结构域和位于N末端(IB类)或C末端(IA类)的[2Fe-2S]氧化还原中心。
在先前的工作中,我们已经显示亲本菌株红平红球菌SQ1中kshA1(突变菌株RG2)或kshB(突变菌株RG4)的基因失活导致3-酮类固醇9alpha;-羟基化活性的丧失。因此,这些突变体不能作为唯一的碳和能源在AD和ADD上生长。这种KSH突变菌株具有工业应用,可用于通过生物转化选择性1 - 药学上重要的类固醇的脱氢。有趣的是,菌株RG2对胆固醇的生长与亲本菌株SQ1的生长相当。菌株RG2的培养物对胆固醇的生物转化不会导致预期的类固醇途径中间体(即AD和ADD)的积累,表明存在至少一种另外的降解途径。相比之下,最近显示通过耻垢分枝杆菌mc2155中的转座子诱变使单个kshA基因失活导致13-谷甾醇中AD和ADD的积累。因此,我们预测在红平红球菌中存在另外的kshA基因同源物。最近的研究表明,rhodo-cocci通常含有多个分解代谢基因的同源物,从而大大提高了它们的分解代谢能力。Rhodococcus jostii RHA1基因组序列显示存在多达四种不同的类固醇分解代谢途径,每种途径含有kshA基因同源物。
目前,关于KSH酶/基因的知识非常有限,妨碍了微生物类固醇生物转化领域的工业应用。此外,对KSH酶的研究具有医学重要性。最近显示,编码R. jostii RHA1中胆固醇分解代谢途径的基因簇与结核分枝杆菌的致病性有关。结核分枝杆菌是结核病的致病因子,每年导致数百万人死亡。值得注意的是,编码由类固醇开环参与的酶的基因,即由Rv3526编码的KSH和由Rv3537编码的KSTD,被鉴定为巨噬细胞中结核分枝杆菌存活的重要性。KSH酶的医学和应用方面使它们成为潜力无限的酶,可以被更详细地研究。
材料和方法
细菌菌株和生长条件。红球菌(Rhodococcus erythropolis)亲本菌株SQ1和突变菌株在30℃和200rpm下培养。先前描述了突变菌株RG2(kshA1突变体),RG4(kshB突变体)和RG9(kshA1 kstD kstD2突变体)。复合富含培养基(LBP)含有1%(wt / vol)Bacto蛋白胨(Difco),0.5%(wt / vol)酵母提取物和1%(wt / vol)NaCl(21)。矿物质培养基(pH 7)由4.65克/升K2HPO4,1.5克/升NaH2PO4 bull;H2O,3克/升NH4Cl组成, 1克/升MgSO4 bull;7H2O,和1毫升/升五倍稀释的Vishniac微量元素溶液。在高压灭菌之前加入胆固醇(1克/升)和胆酸(1克/升)。将其他类固醇(0.5g /升)溶解于二甲基亚砜(DMSO; 50mg / ml)中并加入高压灭菌的培养基中。蔗糖的敏感性在补充有10%(wt / vol)蔗糖的LBP琼脂上测试红球菌属菌株。大肠杆菌菌株在37℃下在(LB)肉汤中生长。加入Bacto琼脂(1.5%[wt / vol]; Difco)用于在固体培养基上生长。
使用简并引物对基因组文库进行PCR筛选。PCR在由Tris-HCl(10mM,pH 8)缓冲液,聚合酶缓冲液,脱氧核苷三磷酸(0.2mM),DMSO(2%),KshAType-F引物(10ng /mu;l)组成的反应混合物(50mu;l)中进行。 ),KshAType-R引物(10 ng /mu;l)和Taq或Vent聚合酶(2 U)在以下条件下:95°C 5分钟,95°C 1分钟,60°C 45秒30个循环,在72℃下1分钟,然后在72℃下5分钟。先前描述的红平红球菌RG1的基因组文库,亲本菌株SQ1的kstD突变体,用作模板。
RNA分离和RT-PCR实验。将红球菌培养物在LBP培养基(250ml)中培养直至达到约600的600nm的光密度。适当时,用溶解在DMSO中的类固醇(0.5g /升)诱导培养物4小时。离心(10分钟,7,300times;g,4℃)后,将细胞沉淀物用研杵和研钵在液体N2 中压碎,并储存在-80℃直至使用。随后使用RNeasy分离试剂盒(Qiagen)分离总RNA。在逆转录酶-PCR(RT-PCR)之前,将分离的总RNA用DNase I扩增级试剂盒(Invitrogen,The Netherlands)在室温下处理15分钟。将DNase I在65℃下加热灭活10分钟。使用SuperScript III Platinum One Step GRT-PCR系统试剂盒(Invitrogen,The Netherlands),在GeneQuant分光光度计上测定约0.5mu;g总RNA进行RT-PCR。根据制造商的建议使用所有试剂盒。通过逆转录酶反应制备的cDNA(在50℃下15分钟)在95℃下加热2分钟并用于PCR(40个循环,在95℃下30秒,在60℃下30秒,和在1.5℃下1.5分钟)。 72℃)。用于RT-PCR实验的基因特异性引物列于表1中。
构建诱变质粒pKSH310用于kshA2无标记基因缺失。用pKSH310实现kshA2的基因缺失。pAR1的1.2kb SalI片段(本研究;参见结果),代表pAR1的上游区域将kshA2克隆到XhoI消化的pBluescript(II)KS中并命名为pKSH307。使用菌株SQ1基因组DNA用引物KSHA2-F和delKSHA2-R(表1)获得的PCR产物(2.2kb)克隆到EcoRV消化的pZeRO-2.1载体(Invitrogen)中,得到pKSH308。随后将含有kshA2下游区域的pKSH308的1-kb SalI / SpeI片段连接到SalI / SpeI消化的pKSH307中,从而产生pKSH309。然后通过Asp718I / XbaI消化从pKSH309中取出含有kshA2缺失的两个连接片段,用Klenow酶处理,并克隆到消化的pK18mobsacB载体中,从而产生pKSH310(图2)。
构建未标记的基因缺失突变体RG23,RG24和RG27。使用如前所述的未标记基因缺失方法构建基因缺失突变体。通过使用大肠杆菌S17-1的细菌缀合将诱变质粒pKSH310引入红平红球菌SQ1和RG2中以构建kshA2突变菌株RG23和kshA1kshA2突变菌株RG24。将诱变质粒pKSH126导入红平红球菌RG4以构建kshA1 kshB突变菌株RG27。使用基因特异性引物通过PCR确认基因缺失(表1)。
功能互补实验和使用的质粒构建。如前所述制备并转化电感受态红球菌细胞。将红球菌转化体复制到含有AD或ADD(0.5克/升)作为唯一碳和能量的矿物琼脂培养基上资源。在30℃温育3天后评估生长的功能互补。用于功能互补实验的质粒pKSH312和pKSH313(图3)如下构建。使用kshA2引物KSHA2EX-F和KSHA2EX-R(表1)通过PCR扩增kshA2基因,随后作为NdeI / SpeI片段克隆到NdeI / SpeI消化的pRESX中(图3),得到质粒pKSH312(图3)。通过将含有kshB的pKSH207的1.46-kb NsiI / SpeI片段连接到NsiI / SpeI消化的pKSH312中构建用于同时表达kshA2和kshB的质粒pKSH313。
气相色谱法和高压液相色谱法进行生物转化实验和分析。在含有100-LBP生长的红平红球菌菌株培养物的摇瓶中进行类固醇生物转化和类固醇分析(一式两份),基本上如前所述。
使用寡核苷酸BLF和BLR通过PCR从pBluescript(II)KS扩增(表1)。将获得的PCR产物用NdeI / SpeI消化并克隆到NdeI / SpeI消化的pRESX中(图3)。随后在BstXI / SpeI消化后从pRESX-BLAS分离无前导bla基因,包括红球菌核糖体结合位点序列。在SpeI消化之前,通过T4 DNA聚合酶处理使BstXI位点变钝。将得到的DNA片段在kshA2启动子的控制下克隆到EcoRV / SpeI-中。
结果
设计简并PCR引物,用于鉴定kshA1突变红细胞红球菌菌株RG2中的其他kshA同源物。开发简并的kshA PCR引物KshA-Type-F和KshAType-R(图2;表1)以筛选kshA1基因缺失突变株RG2中kshA基因同源物的存在。使用KshA1和推定的放线菌的氨基酸序列比对,在保守的Rieske [2Fe-2S]结构域(KshA1中的99 CPFHDWRWG 107)和非血清Fe(II)结合结构域(KshA1中的191 DMAHFFYVH 199)上设计简并引物。 BLAST在数据库中发现的直向同源物。用这些简并引物对菌株RG2的总DNA进行PCR实验,得到预期大小(0.3kb)的PCR产物。核苷酸序列分析显示克隆了部分kshA同源物,其与kshA1非常相似但不完全相同;因此,它被指定为kshA2。
红细胞红球菌SQ1克隆kshA2。使用简并kshA1 PCR引物筛选红平红球菌菌株RG1的基因组文库,分离含有kshA2基因的克隆,命名为pAR1。该克隆的核苷酸测序显示kshA2基因的3#39;末端部分不存在。因此,使用新设计的kshA2-F和KshA2-R(表1)通过PCR再次筛选基因组文库,用于含有kshA2的3#39;末端的另外的克隆。引物KshA2-F和KshA2-R分别在保守的Rieske [2Fe-2S]结构域(LDAYCRH)和保守的VLINCHYP基序上设计。从两个kshA2阳性克隆的测序数据确定完整kshA2基因的核苷酸序列(1,167个核苷酸)。kshA2(GC含量,58.2%)编码蛋白质(KshA2)388个氨基酸,计算分子量为44 kDa。KshA2显示出与R. jostii RHA1(11)的Ro05811最高的总氨基酸序列同一性(63%)。还发现了红平红球菌SQ1的KshA1的高序列同一性(60%)。典型的IA类末端加氧酶Rieske型[2Fe-2S]r 结构域(CXHX16-CX2-H)和单核,非血红素Fe(II)结合基序(D / E-X3-D-先前在KshA1中鉴定的X2-H-X4-H)在KshA2中也是完全保守的。
转录分析显示kshA2是类固醇可诱导的。为了验证kshA2参与红平红球菌菌株SQ1中的类固醇分解代谢,我们通过RT-PCR进行了kshA2基因表达的转录分析。在AD诱导后在复合培养基(LBP)中生长的亲本菌株SQ1的细胞培养物中观察到显着量的kshA2 RNA转录物(图4,泳道2)。在没有类固醇诱导的对照细胞培养物中发现了非常低水平的kshA2 RNA转录物(图4,泳道1)。因此,kshA2是类固醇可诱导的并且很可能是类固醇分解代谢途径的一部分。kshA1突变株RG2不能在AD上生长,显然未能使用KshA2。因此,KshA2诱导可能需要进一步转化AD,这在野生型菌株SQ1中是可能的,但在菌株RG2中不是。
kshA2编码KSH活性并受转录控制。为了确定kshA2是否能够在功能上补充kshA1突变株RG2的AD生长阴性表型并因此是否编码KSH活性,我们通过将kshA2置于kstD启动子的控制下来强制在菌株RG2中表达kshA2。kstD将没有其调节基因kstR的启动子区克隆到pRESQ中,产生质粒pRESX,并导致红平红球菌中的组成型基因表达(图3)(未发表的数据)。将kshA2基因克隆到kstD启动子控制下的pRESX中,并通过电转化将所得质粒pKSH312(图3)导入突变菌株RG2中。观察到含有pKSH312的菌株RG2的AD生长阴性表型的功能互补(图5),证实kshA2确实是kshA1同源物,编码在红平红球菌菌株SQ1
全文共9154字,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[453444],资料为PDF文档或Word文档,PDF文档可免费转换为Word
以上是毕业论文外文翻译,课题毕业论文、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。
您可能感兴趣的文章
- 通过高效供应一碳单位提高工程大肠杆菌中L-蛋氨酸的产量外文翻译资料
- 基于功能组学分析嗜热真菌嗜热毛壳菌纤维素降解机制外文翻译资料
- 采用原位分离丁醇的方式提高菠萝叶木质素水解物发酵产丁醇的量外文翻译资料
- 含锆金属有机框架和微波加热,将葡萄糖转化为5-羟甲基糠醛外文翻译资料
- 零价纳米铁颗粒和根际微生物对白柳植物修复能力的影响极其响应外文翻译资料
- 超声辅助深共晶溶剂萃取法绿色高效提取黄酮类化合物外文翻译资料
- 工业发酵过程中微生物竞争优势的代谢工程外文翻译资料
- w-转氨酶级联反应的最新进展外文翻译资料
- Bi2WO6微/纳米结构:合成、改性及可见光驱动光催化应用外文翻译资料
- 磷酸氧阴离子修饰的Bi2WO6/聚酰亚胺复合材料对四环素的太阳光催化降解外文翻译资料


