在哺乳动物的耳蜗中lmo4作为感觉器官形成的负调节因子的功能
原文作者 Min Deng,1* Xiong-jian Luo,2* Ling Pan,1 Hua Yang,1 Xiaoling Xie,1 Guoqing Liang,3 Liang Huang,1,4 Fang Hu,1,4 Amy E. Kiernan,1 and Lin Gan1,3
摘要:在哺乳动物,听觉感觉器官(螺旋器)的形成是限定在耳蜗的特定区域内的。然而,在耳蜗侧面分散区域中限制性感觉器官形成的分子机制尚不清楚,也不知耳蜗的其他区域是是否有形成螺旋器的能力。我们确定在限定区域内唯一的核酸蛋白——LMO4是耳蜗内听觉感觉器官形成的负调节蛋白。老鼠的Lom4的失活会导致异常的螺旋器位于侧耳蜗。这种螺旋器具有固有器官的特点,它包括内外毛细胞、支持细胞和其他非感觉特殊的细胞类型。但是,异位螺旋器在方向上与固有螺旋器相反,像螺旋器是固有器官的镜像复制。这些数据表明这个在侧耳蜗管由lmo4调控的这片新颖的感觉的区域或许可应用于治疗操作。
关键词:内耳的发育、限制区域、LMO4、螺旋器、耳蜗、转录调节因子
前言
不像是鱼类、两栖类以及鸟类的感觉器官,哺乳动物没有耳蜗的毛细胞和支持细胞就会造成了永久性的听力缺陷,而这种听力缺陷是由于感觉细胞无法自发的再生。哺乳动物的螺旋器具有独特的结构,其中毛细胞和支持细胞是由成排状且内嵌有支持细胞的毛细胞以一种紧密有序的模式排列的。虽然在诱导耳内感觉或毛细胞形成的分子机制上有了很大的进展(Bermingham et al., 1999; Zheng and Gao, 2000; Mizutari et al.,2013),但对于调节耳蜗内螺旋器形成的因素却不了解。
先前,曾报道了核酸蛋白LMO系列——LOM1、LOM3、LOM4在发育中的内耳在时间在空间上的不同区域表达(Deng et al.,2006, 2010)。为了了解LMO4在内耳发育中的作用,我们需要以lacZ的敲入和有条件的敲出处理来灭活LMO4(Deng et al., 2010)。基本上敲出后都表现了一种相似的表现型,其中前庭区域出现严重的畸变(Deng et al., 2010)。形态基因的缺陷是由于在耳泡外侧LMO4的未表达引起的,进而导致了早期结构的缺陷(Deng et al., 2010)。然而,耳蜗在缺失LMO4的小鼠中也可以形成。只是形成的耳蜗比起野生型来说比较小。另外,在缺失LMO4基因的前提下,螺旋器的发育也是可以检测出来的。
目前,我们已经明确LMO4在耳蜗管侧面的那片新颖的感觉区域其起负调节作用。我们发现LMO4在正在发育的小鼠耳蜗中会持续不断的表达,而且小鼠LMO4的失活会导致在耳蜗侧面形成异常的螺旋器。但是比较有趣的是,这种异常的螺旋器保留了正常螺旋器的功能,在结构上也与正常螺旋器高度相似,并且正常的螺旋器中所有的细胞类型在这种异常的螺旋器中也都存在,它其中包括内外毛细胞、支持细胞和其他非感觉的特殊的细胞类型。在目前的研究中,这是首个异常的螺旋器可以通过操纵LMO4基因再生的案例。这种发现对于听力缺陷的治疗来说具有重大的意义。
材料和方法
小鼠:先前报道中所提到的敲入Lacz的LMO4和条件敲出的LMO4的小鼠(Deng et al., 2010),并把在其上观察到阴道栓的一天定义为胚胎天(E0.5)。在这项研究中所有动物的使用流程都是经过在罗切斯特大学的动物资源大学委员会所允许的。所有的实验将在老鼠的任一性别上都进行(对于每种基因型的试验次数大于等于3)。
半乳糖着色:为了确定LMO4—Lacz的表达模式,用半乳糖着色法检测beta;-半乳糖苷酶的活性(Gan et al., 1999)。任一性别的老鼠胚胎都可在4%多聚甲醛(PEA)的磷酸盐缓冲液(PBS)在4℃下可以存在一小时。整装胚胎或在20mu;m厚的冰冻切片室温下用0.1%的半乳糖苷、5毫摩尔的铁氰化钾、5毫摩尔的亚铁氰化钾、2毫摩尔的Mgcl于PBS中进行染色过夜。
免疫组织化学和扫描电子显微镜法:扫描电子显微镜(SEM)实验如先前杂志中描述的(Deng et al., 2010; Pan et al., 2013)。对于冰冻切片上的免疫组织,在不同阶段任一性别的胚胎的头部可以在4%PEA的PBS中固定一小时。用PBS洗涤三次后,组织脱水是在20%的蔗糖的PBS溶液中过夜,放入OCT冰冻切片包埋剂中并切片其厚度在14-20微米。各部分的免疫标记如之前的描述(Deng et al., 2010; Luo et al., 2013)。对于整装免疫组织,P5幼仔的内耳在PBS中分离,然后在冰的HBSS(载体)中用胶原酶(1㎎/ml)和中性蛋白酶(1㎎/ml)处理8min;用DMEM/F12(含有5%FBS)替换HBSS溶液bong温育30min;然后耳蜗在4℃下4%PFA的PBS中固定一小时,PBS溶液洗涤三次后在解剖显微镜下解剖。对于免疫染色,耳蜗在加入0.1%聚乙二醇辛基苯甲醚、0.03%皂苷、10%马血清的PBS溶液中是通透的和被封锁的,在室温下培养30min后主要的抗体(在加入入0.1%聚乙二醇辛基苯甲醚、0.03%皂苷、3%马血清、3%BSA的PBS溶液中稀释的)数量增加并在4℃下过夜培养,第二天,耳蜗在PBS溶液中洗涤八小时(PBS每两小时更换一次),洗涤后,荧光标记二抗在4℃过夜培养。
在此研究中使用的第一抗体和浓度如下:兔子抗体MYO6(Proteus Biosciences; 1:500),山羊抗体SOX2(Santa Cruz Biotechnology; 1:500),兔子抗体SOX2(微孔;1:500),兔子抗体S100A1(Dako; 1:50),小鼠抗体的p27kip1(BD PharMingen;1:200),),山羊抗体JAG1(Santa Cruz Biotechnology; 1:200),兔子抗体P75(Millipore; 1:100),兔子抗体pSMAD1/ 5/8(Cell Signaling Technology;1:75),兔子抗体CASP3(Ramp;D Systems; 1:500)。图像用Zeiss510 META共焦显微镜拍摄。
原位混合法:原位混合法如杂志所说(Yang et al., 2003),简而言之就是,将胚胎在冰的PBS上解剖并在4%多聚甲醛的PBS溶液中固定并过夜;在20%蔗糖中过夜冷冻后,将胚胎放入OCT中并用干冰快速冷却;将组织切片厚度是20mu;m;对于Bmp4(a gift from Dr James F. Martin, Baylor College of Medicine, Houston, TX)的一种特定的异羟基洋地黄酸苷标记的核糖核酸探针来检测mRNA的表达。
结果
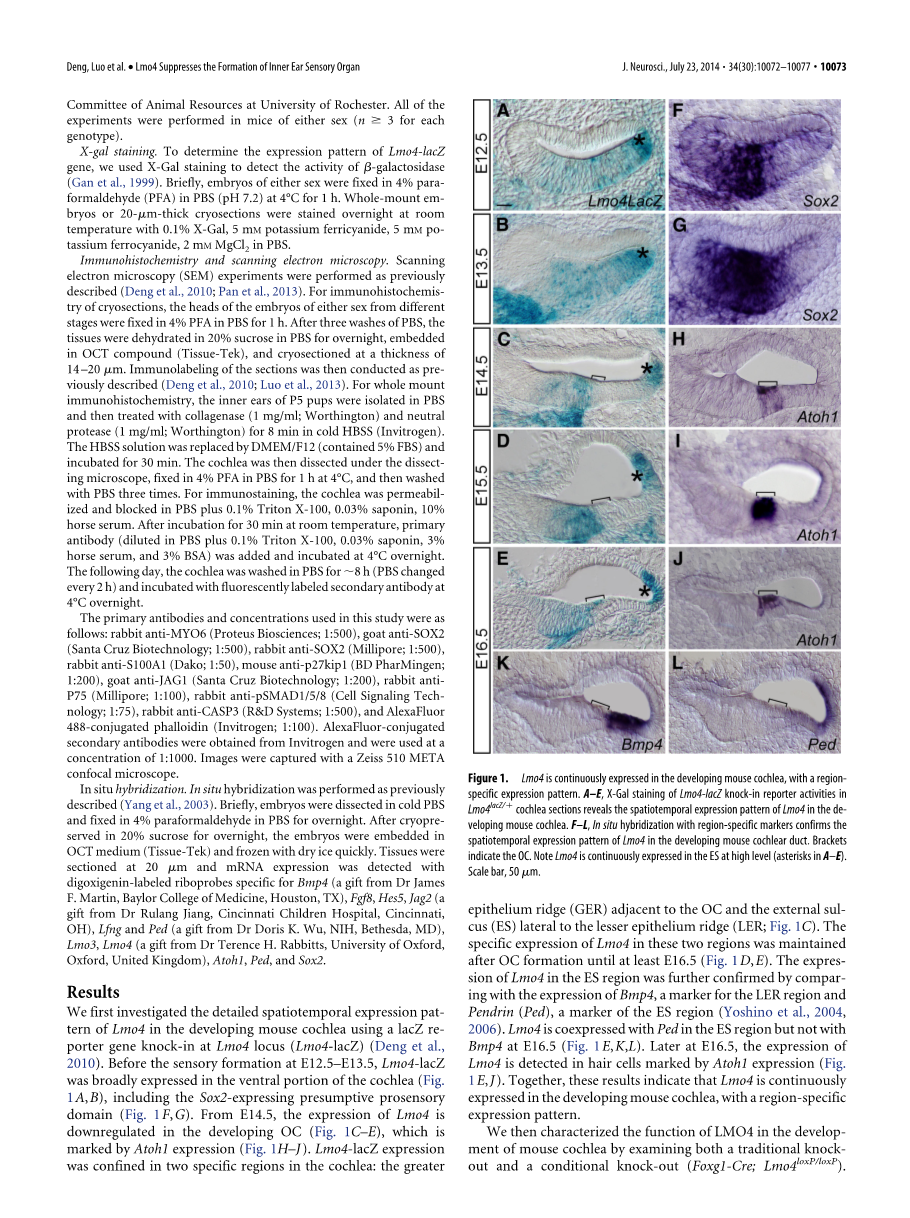
我们首先研究的是在发育中的小鼠耳蜗中在Lmo4敲入报告基因LacZ(Lmo4-lacZ)后Lmo4时间和空间上详细的表达模式(Deng et al.,2010)。在E12.5-E13.5感官形成之前,LMO4-lacZ已经在耳蜗(Fig.1A,B)的腹侧部广泛地表达,包括Sox2在prosensory区域的表达推定(Fig. 1F,G)。从E14.5开始,LMO4的表达在发育中的螺旋器OC受到抑制(Fig. 1C–E),螺旋器是由Atoh1的表达(Fig. 1H–J)而被标记的。LMO4-lacZ的表达只限于在耳蜗两个特定的区域中:与螺旋器相邻的较大的上皮脊(GER)和较小上皮脊(LER; Fig. 1C)的外部沟(ES)侧部。LMO4在这两个地区的具体表达是从螺旋器形成后到E16.5(Fig. 1D,E)。LMO4的在ES区域的表达通过BMP4,而BMP4用于LER区域和Pendrin(PED)的标记物和ES区域的标志物的比较进一步被证实(Yoshino et al., 2004,2006)。在E16.5时LMO4在ES区域与PED共表达,而不是与Bmp4(Fig. 1E,K,L)。在E16.5后,在由Atoh1的表达(Fig.1E, J)标记的毛细胞中检测到LMO4的表达。总之,这些结果表明,LMO4在发育的小鼠耳蜗以区域特异性的表达模式持续表达。
然后,我们通过研究这两个传统的敲除和有条件敲除(Foxg1-Cre; Lmo4loxP/loxP)来描述LMO4在发育的小鼠耳蜗中的功能。与野生对照型(Fig. 2A)相比,在E16 LMO4空耳蜗中的底部检测到异位毛细胞(Fig. 2B, asterisk)。在E17.5,毛细胞的区域则出现在耳蜗侧面的中间和顶端处(Fig. 2C–H)。接着,毛细胞的两个区域合并在一起形成毛细胞的扩展域(Fig. 2H),可能是由于中间细胞的凋亡。
出生后5天的小鼠(P5),毛细胞的扩展区域存在于耳蜗的中间和顶部区域,而这两个包含被非感觉细胞所分开的两个毛细胞的功能区域(Fig. 2I, J,I, J)。在耳蜗中与一排P75阳性支持细胞比较看,除了正常的一排支持细胞外在耳蜗管的中间(Fig.2J, arrow)Lmo4无效是还能观察到一排异常的支持细胞(箭头)。有趣的是,异位毛细胞出现在此区域内并且杂乱无章。因此,我们想知道在耳蜗中LMO4无效时毛细胞的平面细胞极性(PCP)是否受到影响。在野生型对照型中,毛细胞排列有序并且外毛细胞的所有静纤毛指向相同的方向(Fig.2K)。在LMO4无效小鼠中,异位毛细胞形成的区域中的毛细胞的取向是打乱(Fig. 2L)。与野生型对照型观察到的正常PCP相比,在LMO4无效的小鼠的异常毛细胞的形成域中毛细胞的PCP是混乱的和外毛细胞的静纤毛的方向是随机的、无规则的,这大概是因为在变小的LMO4无效的耳蜗中毛细胞的细胞密度变大。
在结构上,毛细胞的异常区域与正常的OC区域相似(Fig. 2A–H, brackets)。随后,我们用标记毛细胞、支持细胞和其它耳蜗区域毛细胞方法来观察毛细胞的异常区域。我们发现在异位区域中MYO6、鬼笔环肽、Atoh1和Jag2这些特殊毛细胞标记物都正常地表达了(Figs. 2,D,F,H,M-P- '; 3A-B)。关于作为标记内毛细胞和支持细胞的S100A1表达的分析,(Woods et al., 2004; Kiernan et al., 2006),它在异常区域的横向侧的内毛细胞上被识别(Fig. 2Q,R)。此外,标记内毛细胞的FGF8的表达((Pirvola et al., 2002;Shim et al., 2005)出现在耳蜗背外侧区域的内毛细胞中,这证实了异常区域也包含内毛细胞在内(Fig. 3C,C′)。通过比较Jag2和 FGF8表达的位置,出现异常的FGF8表达的内毛细胞是位于上异常感官区域的侧面,而不是内侧。
接下来,我们试图确定在异常区域是否存有支持细胞的形成。利用许多支持细胞标记物我们已确定支持细胞存在于异常区域,并且它们表达了OC区域内正常表达的适当的标记物,包括P75,PROX1,JAG1,HES5和Lfng(Figs. 2I–J′, M–P′ ,3D–E′)。不像JAG1,HES5和Lfng,这些是在OC的支持细胞中表达,而P75是唯一在支持细胞中表达(Mueller et al., 2002;Doetzlhofer et al., 2009),它也是专门区分支持细胞和内、外毛细胞的。
我们研究在P5时用鬼笔环肽标记的全组织标本包埋P75时的表达。我们发现LMO4无效突变体在耳蜗的中间和顶部有P75表达的重复结构域(Fig. 2I–J′)。额外的结构域位于耳蜗的非蜗轴(横)侧,这个区域大多数毛细胞位于正常和异常的结构域之间(Fig. 2J′),这表明异常感官区域包含支持细胞。总之,我们的结果表明LMO4无效的耳蜗的异常螺旋器(eOC)的形成有完整的毛细胞和支持细胞,并且eOC与正常OC之间的方向相反。
我们还研究了OC外的选择性区域的标记物,如BMP4和Lmo3,这两个是 剩余内容已隐藏,支付完成后下载完整资料
资料编号:[286531],资料为PDF文档或Word文档,PDF文档可免费转换为Word
以上是毕业论文外文翻译,课题毕业论文、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。
您可能感兴趣的文章
- Eupholides A− H,来自大戟根部的松香烷二萜类化合物及其生物活性外文翻译资料
- 响应面法优化杨花总黄酮含量外文翻译资料
- 乳酸链球菌*属保加利亚乳杆菌中β-半乳糖苷酶基的构建和分泌表达外文翻译资料
- 高温胁迫对淡水藻类四尾栅藻的生长及其热激蛋白表达的影响外文翻译资料
- α-萜品醇对绿霉的生长和形态的影响外文翻译资料
- 柑橘精油对意大利青霉和绿霉的抗真菌活性研究外文翻译资料
- Erigeroflavanone(一种来自灯盏花的新化合物)对培养的小鼠系膜细胞中过氧化氢损伤而诱导细胞死亡的保护作用外文翻译资料
- 响应面法优化蛹虫草类胡萝卜素抗氧化剂的酶辅助提取工艺外文翻译资料
- 水稻中低植酸种质的描述和研究(栽培稻)外文翻译资料
- 蜜蜂研究所在蜂胶多酚类成分的提取鉴定方面取得新进展外文翻译资料