
英语原文共 12 页,剩余内容已隐藏,支付完成后下载完整资料
J. Chem. Thermodynamics 62 (2013) 118–129
用基团贡献法预测选定药物在水和醇中的溶解度
Aleksandra Pelczarska a, Deresh Ramjugernath b, Jurgen Rarey b,c, Urszula Domanacute; ska a,b,uArr;
a Department of Physical Chemistry, Faculty of Chemistry, Warsaw University of Technology, Noakowskiego 3, 00-664 Warsaw, Poland
b Thermodynamic Research Unit, School of Engineering, University of KwaZulu-Natal, Howard College Campus, King George V Avenue, Durban 4041, South Africa
c Industrial Chemistry Group, Carl von Ossietzky University of Oldenburg, 26111 Oldenburg, Germany
摘要:
我们小组提出了一种改进的无限稀释活度系数基团贡献法,用于预测选定药物在水和醇中的溶解度[·莫勒,《复杂多功能有机化合物在常见溶剂中的活度》,夸祖鲁-纳塔尔大学化学工程博士论文,2009年]。利用该基团贡献模型,在相当宽的温度范围内预测了16种不同药物在水、乙醇和正辛醇中的溶解度。我们将预测值与Schroeder-van-Laar方程计算值和我们先前发表的42种二元混合物的实验结果进行了比较。大多数混合物的预测溶解度值低于实验值。为了改进预测方法,我们使用了一个实验溶解度值进行半预测计算。当与实验值进行比较时,这种单点预测给出了可接受的结果。
关键词:
水和醇中溶解度的预测、改进的基团贡献模型制药
1.引言
药物在水中的溶解度是一个非常重要的分子特性,因为它提供了药物在人体内的释放、转运和吸收程度的良好指标。药物在乙醇或正辛醇中的溶解度信息对于选择药物进入人体的介质很重要。缺乏高质量的溶解度数据集对我们创建溶解度预测模型的能力有巨大影响。在过去几年中,人们已经提出了许多预测药物溶解度的方法,因为溶解度的知识是控制药物进入生物膜的关键因素。
考虑到用于预测活性系数和随后溶解度的基团贡献法,最古老的是UNIFAC和DISQUAC [1,2],其要求物质的熔融焓和熔点,或AQUAFAC [3,4],其要求固体药物的熔融熵或熔点。一般溶剂化方程和修正的溶剂化能关系[5] 给出了在单一温度下600多种化合物的令人满意的预测。
本文还研究和评价了改进的扩展Hansen法,特别是对含单一氢键基团的酸性药物。该方法利用了药物实验摩尔分数溶解度与溶剂部分溶解度参数的对数回归分析。
在药剂学中,药物的溶解度通常表示为对数S,其中S是饱和水溶液在固态平衡时化合物的浓度(单位:mol/dmsup3;)。对于可电离物质,如胺或羧酸,应研究其pH曲线的溶解度,以获得化合物的固有溶解度S0。 实验数据很少,通常报告有很大的不确定性[7-9]。由于没有pH值,化合物不会部分电离,氨基酸也会遇到其他问题,因为没有pH值时化合物不会部分电离[10]。所有用于对数S预测的方法都基于定量结构-性质关系(QSPR)方法,并且基于实验溶解度值发展而来。因此,该方法的准确度几乎完全取决于实验不确定度。QSPR方法中使用的一些典型描述是摩尔质量、溶剂-可接受的表面积、水溶液中的潜在给体和受体氢键数,特定官能团和可旋转键的数目,量子力学计算的静电势数据和许多其他描述。QSPR方法需要相当复杂的回归软件来生成所用描述符的值。尽管如此,这种方法在制药公司很流行,并且随着大量关于晶体结构和分子间氢键的信息的提供,给出了改进的结果[11-13]。
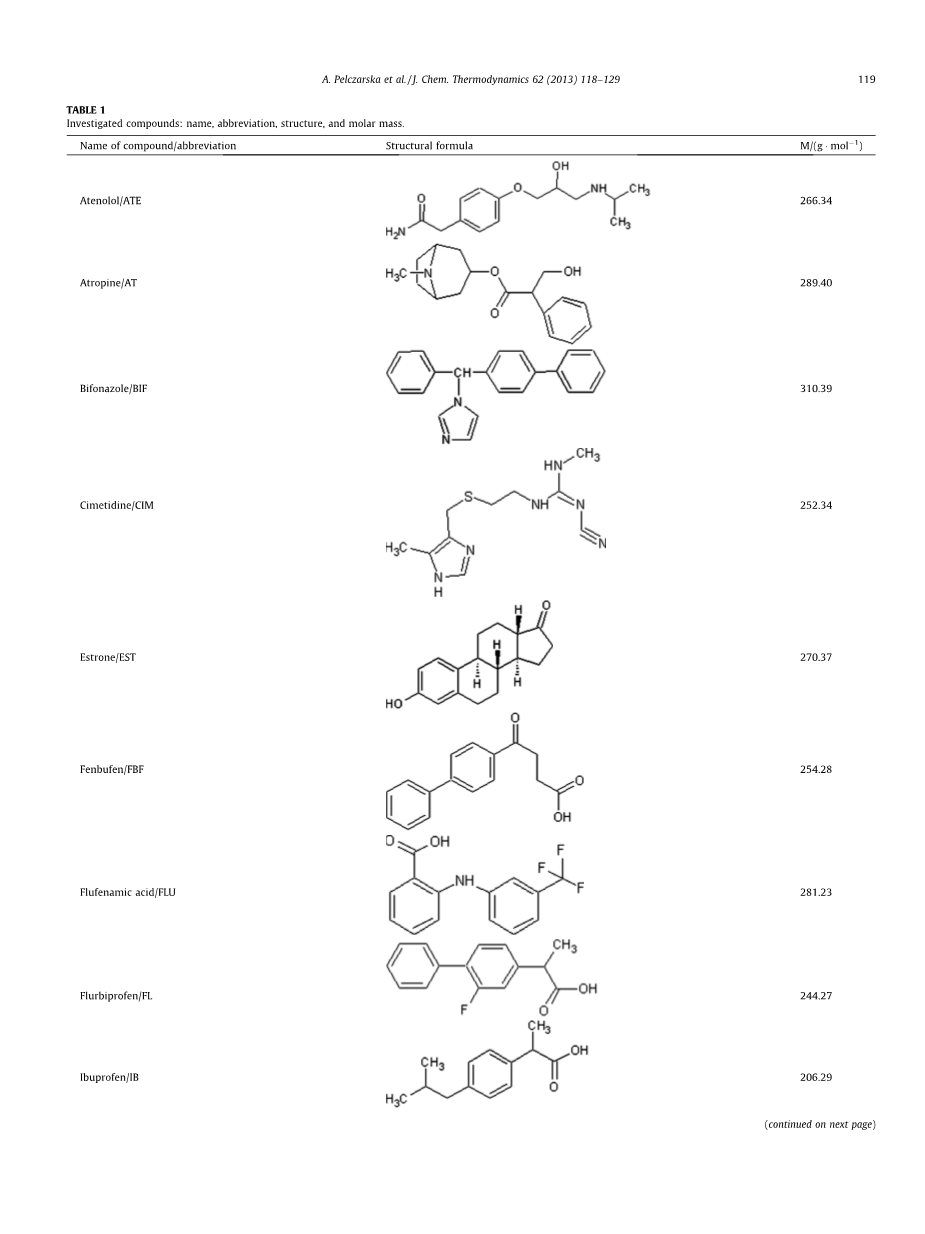
表1:研究化合物:名称、缩写、结构和摩尔质量
|
化合物名称/缩写 |
结构式 |
摩尔质量 |
|
阿替洛尔(Atenolol)/ATE |
266.34 |
|
|
阿托品(Atropine)/AT |
289.40 |
|
|
联苯苄唑(Bifonazole)/BIF |
310.39 |
|
|
西咪替丁(Cimetidine)/CIM |
252.34 |
|
|
雌酮(Estrone)/EST |
270.37 |
|
|
芬布芬(Fenbufen)/FBF |
254.28 |
|
|
氟芬那酸(Flufenamic acid)/FLU |
281.23 |
|
|
氟比洛芬(Flurbiprofen)/FL |
244.27 |
|
|
布洛芬(Ibuprofen)/IB |
206.29 |
|
|
甲芬那酸(Mefenamic acid)/MEF |
241.30 |
|
|
纳多洛尔(Nadolol)/NAD |
309.40 |
|
|
硝氟酸(Niflumic acid)/NIF |
282.22 |
|
|
尼美舒利(Nimesulide)/ NIM |
308.31 |
|
|
己酮可可碱(Pentoxifylline)/ PE |
278.30 |
|
|
苯基丁氮酮(Phenylbutazone)/ PHBU |
308.37 |
|
|
三安替林(Triamterene)/ TAT |
253.26 |
如今,热力学模型在药物设计中也非常流行。合成药物需要了解药物在溶剂或溶剂混合物中的溶解度。一种快速、可靠的,药物在各种混合溶剂组成组合中溶解度的信息来源,可以降低成本,提高新药开发的成功率。
从统计力学发展起来的状态方程模型也已应用于药物溶解度的计算。非随机氢键理论(NRHB)是一种基于晶格的模型,已用于预测药物在纯溶剂和混合溶剂中的溶解度,其参数由含有相同官能团的简单分子获得[14,15]。微扰链统计缔合流体理论(PC-SAFT)的预测能力已应用于常用药物在纯溶剂和二元溶剂混合物中的药物相关性和预测[16-18]。
该模型的参数与水、甲醇和苯中的实验溶解度值相吻合,而且就该方法的预测能力,使得它对不同溶剂、混合溶剂体系和溶解度的温度依赖性是可接受的。
最近,类导体筛选(COSMO-SAC)活性系数模型(其仅需要熔融焓和熔融温度[19,20)和使用有限数量的实验值[21,22]的常用的非随机双液体(NRTL-SAC)模型被用于预测药物的溶解度。理想溶解度、扩展的汉森溶解度方法、UNIFAC、Mod提供了溶解度预测模型之间有趣的比较。UNIFAC (Do)、COSMO-RS (01)、NRTL-SAC和新的制药模型。这些模型由Diedrichs和Gmehling提出,用于研究药物在烷烃、醇、水及其混合物中的溶解度[23]。UNIFAC模型对药物活性成分的溶解度给出了最好的结果。由于这些化合物在水和其他溶剂中的溶解度较低(因为熔融温度较高),因此在假设溶液中存在少量相互作用参数的情况下(溶剂-溶剂相互作用的溶剂的结构基团以及溶质和溶剂的结构基团),计算无限稀释时的值。溶质组之间的相互作用参数设置为零[23]。
图 1:用主成分分析(PCA)研究所选数据集的异质性。(a) 绘制两个第一主分量(F1-F2)。(b) 绘制第一和第三主成分图(F1-F3)
图 2:实验温度与摩尔分数的关系图[31]和{ATE(1) 溶剂(2)}在二元体系中的预测溶解度:■,水;▲,乙醇;●,正辛醇;—,水;— —,乙醇;- -,正辛醇; ···,水的半预测模型;-bull;,乙醇的半预测模型;—bull;,正辛醇的半预测模型
图 3:实验温度与摩尔分数的关系图[32],并用改进的基团贡献法预测溶解度:▲,乙醇;●,正辛醇;—,水— —,乙醇;- -,正辛醇;-·,乙醇的半预测模型;—·,正辛醇的半预测模型
图 4:实验的温度与摩尔分数的关系图[31],并用改进的基团贡献法预测{BIF(1) 溶剂(2)}在二元体系中的溶解度:■,水;▲,乙醇;●,正辛醇;—,水;——,乙醇;- -,正辛醇; ···,水的半预测模型;-bull;,乙醇的半预测模型;—bull;,正辛醇的半预测模型
图 5:实验的温度与摩尔分数的关系图[33],并用改进的基团贡献法预测{CIM(1) 溶剂(2)}在二元体系中的溶解度:■,水;▲,乙醇;●,正辛醇;—,水;——,乙醇;- -,正辛醇; ···,水的半预测模型;-bull;,乙醇的半预测模型;—bull;,正辛醇的半预测模型
图 6:实验[31]的温度与摩尔分数的关系图,并用改进的基团贡献法预测{EST(1) 溶剂(2)}在二元体系中的溶解度:■,水;▲,乙醇;●,正辛醇;—,水;——,乙醇;- -,正辛醇; ···,水的半预测模型;-bull;,乙醇的半预测模型;—bull;,正辛醇的半预测模型
图 7:实验的温度与摩尔分数的关系图[33],并用改进的基团贡献法预测{FBF(1) 溶剂(2)}在二元体系中的溶解度:■,水; —,水; ——,乙醇;- -,正辛醇; ···,水的半预测模型
图 8:实验的温度与摩尔分数的关系图[34],并用改进的基团贡献法预测{FLU(1) 溶剂(2)}在二元体系中的溶解度:■,水;▲,乙醇;●,正辛醇;—,水;— —,乙醇;- -,正辛醇; ···,水的半预测模型;-bull;,乙醇的半预测模型;—bull;,正辛醇的半预测模型
图 9:实验的温度与摩尔分数的关系图[32],并用改进的基团贡献法预测{FL(1) 溶剂(2)}在二元体系中的溶解度:▲,乙醇;●,正辛醇;—,水;— —,乙醇;- -,正辛醇; -bull;,乙醇的半预测模型;—bull;,正辛醇的半预测模型
图 10:实验的温度与摩尔分数的关系图[32],并用改进的基团贡献法预测{IB(1) 溶剂(2)}在二元体系中的溶解度:▲,乙醇;●,正辛醇;—,水;— —,乙醇;- -,正辛醇; -bull;,乙醇的半预测模型;—bull;,正辛醇的半预测模型
图 11:实验的温度与摩尔分数的关系图[31],并用改进的基团贡献法预测{MEF(1) 溶剂(2)}在二元体系中的溶解度:▲,乙醇;●,正辛醇;—,水;— —,乙醇;- -,正辛醇; -bull;,乙醇的半预测模型;—bull;,正辛醇的半预测模型
图 12:实验的温度与摩尔分数的关系图[31],并用改进的基团贡献法预测{NAD(1) 溶剂(2)}在二元体系中的溶解度:■,水;▲,乙醇;●,正辛醇;—,水;— —,乙醇;- -,正辛醇; ···,水的半预测模型;-bull;,乙醇的半预测模型;—bull;,正辛醇的半预测模型
图 13:实验的温度与摩尔分数的关系图[34],并用改进的基团贡献法预测{NIF(1) 溶剂(2)}在二元体系中的溶解度:■,水;▲,乙醇;●,正辛醇;—,水;— —,乙醇;- -,正辛醇; ···,水的半预测模型;-bull;,乙醇的半预测模型;—bull;,正辛醇的半预测模型
图 14:实验的温度与摩尔分数的关系图[31],并用改进的基团贡献法预测{NIM(1) 溶剂(2)}在二元体系中的溶解度:■,水;▲,乙醇;●,正辛醇;—,水;— —,乙醇;- -,正辛醇; ···,水的半预测模型;-bull;,乙醇的半预测模型;—bull;,正辛醇的半预测模型
图 15:实验的温度与摩尔分数的关系图
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[416396],资料为PDF文档或Word文档,PDF文档可免费转换为Word
以上是毕业论文外文翻译,课题毕业论文、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。
您可能感兴趣的文章
- 通过对奥美拉唑合成反应的监测和定量反应的在线拉曼光谱和表征组件外文翻译资料
- 无金属碳基催化剂的研究进展外文翻译资料
- 钼酸钙/碳三维复合材料可控设计合成的研究外文翻译资料
- 生物催化选择性合成功能化喹唑啉酮衍生物外文翻译资料
- 三元V Zr Al ON氧氮化物-3-甲基吡啶氨氧化的高效催化剂外文翻译资料
- 综述纳米零价铁(nZVI)的合成,特性和在环境修复中的应用外文翻译资料
- 自消毒PVC表面使用点击化学设计外文翻译资料
- 微波辅助直接合成4H-1,2,4-苯并噻二嗪1,1-二氧化物衍生品外文翻译资料
- 微波辅助下直接合成1,1-二氧代-4H-1,2,4-苯并噻二嗪类衍生物外文翻译资料
- 压力选择在变压精馏中的重要性外文翻译资料


