
英语原文共 11 页,剩余内容已隐藏,支付完成后下载完整资料
www.impactjournals.com/oncotarget/ Oncotarget, 2018, Vol. 9, (No. 4), pp: 4511-4521
Research Paper
AMPK activation by Tanshinone IIA protects neuronal cells from oxygen-glucose deprivation
Yingfeng Weng1,*, Jixian Lin1,*, Hui Liu1,*, Hui Wu1, Zhimin Yan1 and Jing Zhao1
1Department of Neurology, Minhang Branch, Zhongshan Hospital, Fudan University, Shanghai, China *Co-first authors
Correspondence to: Jing Zhao, email: zhaojinmhyy7@163.com
Zhimin Yan, email: yanzhiminmh@163.com
Keywords: OGDR; neuroprotection; Tanshinone IIA; AMP-activated protein kinase (AMPK); Ppm1e
Received: October 27, 2017emsp; Accepted: December 01, 2017emsp; Published: December 17, 2017
Copyright: Weng et al. This is an open-access article distributed under the terms of the Creative Commons Attribution License 3.0 (CC BY 3.0), which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
摘要
目前的研究测试了丹参酮ⅡA(ThIIA)在氧糖剥夺(ODG)和再氧合(OGDR)的神经元细胞中的潜在神经保护功能。在SH-SY5Y神经元细胞和原代鼠皮质神经元中,ThIIA预处理减弱了OGDR诱导的存活力降低和细胞凋亡。此外,ThIIA显着减弱了OGDR诱导的线粒体去极化,活性氧产生,脂质过氧化和神经元细胞DNA损伤。 ThIIA激活AMP-激活的蛋白激酶(AMPK)信号,这对于针对OGDR的神经保护是必需的。在SH-SY5Y细胞中AMPKalpha;1敲低或完全敲除废除了ThIIA诱导的AMPK活化和针对OGDR的神经保护作用。进一步的研究发现ThIIA上调microRNA-135b下调AMPK磷酸酶Ppm1e。值得注意的是,通过靶向shRNA敲减Ppm1e或强制microRNA-135b表达也激活AMPK并从OGDR保护SH-SY5Y细胞。一起,ThIIA的AMPK激活保护OGDR的神经元细胞。 microRNA-135b介导的Ppm1e沉默可能是ThIIA激活AMPK的关键机制。
介绍
缺血再灌注应对神经元造成损害[1,2]。在培养的神经元中,应用氧糖剥夺(ODG)和再氧合(OGDR)模拟缺血再灌注损伤[3-6]。丹参酮IIA(ThIIA)是一种来自中药丹参的菲醌衍生物[7,8]。 ThIIA已被用于治疗许多疾病[7,8]。 ThIIA对OGDR的潜在神经保护作用在很大程度上是未知的。
维持神经元的生理能量水平对关键大脑行为至关重要。AMP激活的蛋白激酶(AMPK)是一种重要的能量传感器[9-12]。现有文献表明,生理学AMPK也参与脑发育,神经元极化和其他神经元活动[9-12]。此外,AMPK信号的失调可能参与神经退行性疾病的发展[9-12]。
因此,AMPK正在成为神经退行性疾病的潜在治疗靶点[9-12]。现有证据表明,AMPK信号传导对细胞存活也很重要,特别是在某些压力条件下[13,14]。在这里,我们表明AMPK的激活是ThIIA介导的对OGDR的神经保护作用。
结果
丹参酮IIA保护神经元细胞免受缺氧和缺氧的损害
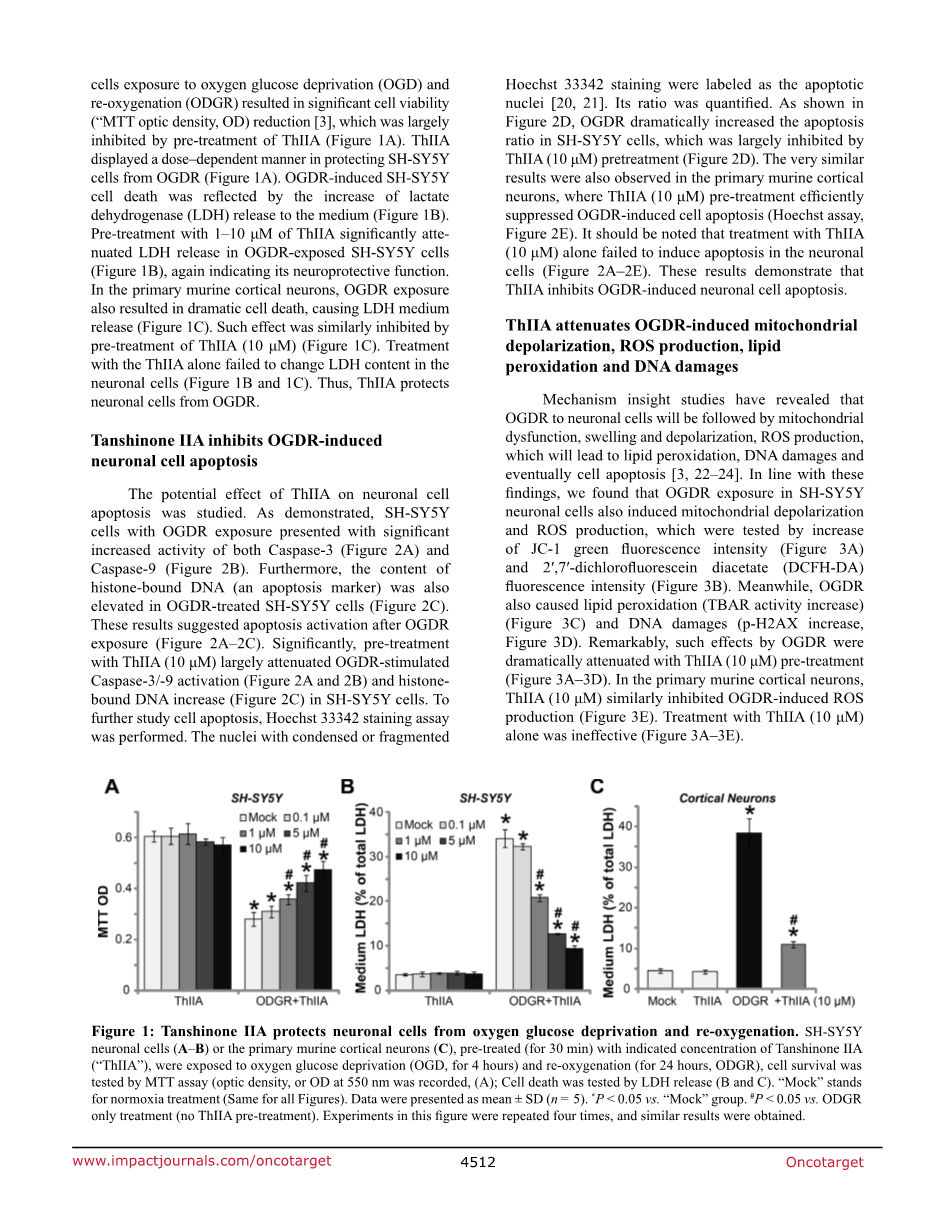
目前的研究旨在了解丹参酮IIA(“ThIIA”)[15,16]在神经元细胞中的潜在作用。 SH-SY5Y是公认的人类神经细胞系[17-19]。图1A中的细胞存活MTT测定结果显示,在测试浓度(0.1-10mu;M)下仅用ThIIA处理未能改变SH-SY5Y细胞存活。与之前的研究结果一致[3],SH-SY5Y细胞暴露于氧糖剥夺(OGD)和再氧合(ODGR)导致显着的细胞活力(“MTT光密度,OD)降低[3] ThIIA的预处理(图1A)。 ThIIA以剂量依赖性方式保护SH-SY5Y细胞免于OGDR(图1A)。 OGDR诱导的SH-SY5Y细胞死亡反映了乳酸脱氢酶(LDH)释放到培养基中的增加(图1B)。用1-10mu;M的ThIIA预处理可显着抑制OGDR暴露的SH-SY5Y细胞中的LDH释放(图1B),这再次表明其具有神经保护功能。在原代小鼠皮质神经元中,OGDR暴露也导致戏剧性的细胞死亡,导致LDH培养基释放(图1C)。通过ThIIA(10mu;M)的预处理类似地抑制这种效应(图1C)。单独使用ThIIA治疗未能改变神经元细胞中的LDH含量(图1B和1C)。因此,ThIIA从OGDR保护神经元细胞。
图1:丹参酮IIA保护神经细胞免受氧糖剥夺和再氧合。 用指示浓度的丹参酮IIA(“ThIIA”)预处理(30分钟)的SH-SY5Y神经元细胞(A-B)或原代鼠皮质神经元(C)暴露于氧葡萄糖剥夺(OGD,4小时)和再氧合(24小时,ODGR)通过MTT测定法测量细胞存活(光密度或550nm处的OD),(A);通过LDH释放测试细胞死亡(B和C),“模拟”代表常氧治疗(所有数字相同)。数据表示为平均值plusmn;SD(n = 5)。*与“模拟”组相比* P lt;0.05。 #P lt;0.05与仅ODGR治疗(无ThIIA预处理)相比。该图中的实验重复三次,并获得类似的结果。
丹参酮IIA抑制OGDR诱导的神经元细胞凋亡
研究了ThIIA对神经细胞凋亡的潜在影响。如所证明的,具有OGDR暴露的SH-SY5Y细胞呈现显着增加的胱天蛋白酶-3(图2A)和胱天蛋白酶-9(图2B)的活性。此外,OGDR处理的SH-SY5Y细胞中组蛋白结合DNA(凋亡标记)的含量也升高(图2C)。这些结果表明OGDR暴露后细胞凋亡的激活(图2A-2C)。显着地,用ThIIA(10mu;M)预处理大大减弱SH-SY5Y细胞中OGDR-刺激的胱天蛋白酶-3 / -9活化(图2A和2B)和组蛋白结合DNA增加(图2C)。为了进一步研究细胞凋亡,进行Hoechst 33342染色测定。 Hoechst 33342染色浓缩或碎裂的细胞核标记为凋亡细胞核[20,21]。它的比例是量化的。如图2D所示,OGDR显着增加了SH-SY5Y细胞的凋亡率,ThIIA(10mu;M)预处理大大抑制了SH-SY5Y细胞的凋亡率(图2D)。在原代鼠皮质神经元中也观察到非常相似的结果,其中ThIIA(10mu;M)预处理有效地抑制了OGDR诱导的细胞凋亡(Hoechst测定,图2E)。应该指出,单独用ThIIA(10mu;M)处理不能诱导神经元细胞凋亡(图2A-2E)。这些结果表明ThIIA抑制OGDR诱导的神经元细胞凋亡。
图2:丹参酮IIA抑制OGDR诱导的神经元细胞凋亡。 将用10mu;M丹参酮IIA(“ThIIA”)预处理(30分钟)的SH-SY5Y神经元细胞(A-D)或原代鼠皮质神经元(E)暴露于氧葡萄糖剥夺(OGD, 4小时)和再氧合(对于施用小时,ODGR),进行文中提及的细胞凋亡测定。数据表示为平均值plusmn;SD(n = 5)。*与“模拟”组相比* P lt;0.05。 #P lt;0.05与仅ODGR治疗(无ThIIA预处理)相比。该图中的实验重复三次,并获得类似的结果。
ThIIA减弱OGDR诱导的线粒体去极化,ROS产生,脂质过氧化和DNA损伤
机制洞察研究表明,OGDR对神经元细胞的作用将伴随着线粒体功能障碍,肿胀和去极化,ROS产生,这将导致脂质过氧化,DNA损伤和最终细胞凋亡[3,22-24]。 根据这些发现,我们发现SH-SY5Y神经元细胞中的OGDR暴露也诱导线粒体去极化和ROS产生,这通过增加JC-1绿色荧光强度(图3A)和2#39;,7#39;-二氯荧光素二乙酸酯 (DCFH-DA)荧光强度(图3B)。 同时,OGDR也引起脂质过氧化(TBAR活性增加)(图3C)和DNA损伤(p-H2AX增加,图3D)。 值得注意的是,用ThIIA(10mu;M)预处理显着减弱了OGDR的这种影响(图3A-3D)。 在原代鼠皮质神经元中,ThIIA(10mu;M)类似地抑制OGDR诱导的ROS产生(图3E)。 单独使用ThIIA(10mu;M)治疗无效(图3A-3E)。
图3:ThIIA减弱OGDR诱导的线粒体去极化,ROS产生,脂质过氧化和DNA损伤。 将用10mu;M丹参酮IIA(“ThIIA”)预处理(30分钟)的SH-SY5Y细胞(A-D)或原代鼠皮质神经元(E)暴露于氧葡萄糖剥夺(OGD,4 小时)和再氧合(ODGR)的时间,线粒体去极化(A),ROS产生(B和E),脂质过氧化(C)和DNA损伤(D)。数据表示为平均值plusmn;SD(n = 5)。*与“模拟”组相比* P lt;0.05。 #P lt;0.05与仅ODGR治疗(无ThIIA预处理)相比。该图中的实验重复三次,并获得类似的结果。
ThIIA激活神经元细胞中的AMPK信号
正如所讨论的,最近的研究表明AMPK的促生存功能[25-27]。 许多AMPK激活剂被证明可以保护细胞免受不同的压力[28-31]。 先前的研究表明ThIIA也能激活AMPK信号传导[32,33]。 因此,我们在ThIIA处理的神经元细胞中检查了AMPK信号传导。 如图4A所示,在SH-SY5Y细胞中,ThIIA剂量依赖性地诱导AMPK激活,这通过AMPKalpha;1(在Thr-172处)和其主要下游靶标乙酰-CoA羧化酶(ACC,在Ser-79)。 同时,AMPK激活也通过Th1IA处理的SH-SY5Y细胞中AMPKalpha;活性的增加得到证实(图4B)。 在ThIIA处理的原代鼠皮质神经元中也获得了类似的结果,其中AMPK / ACC磷酸化(图4C)和AMPKalpha;活性(图4D)显着增强。 这些结果暗示ThIIA激活神经元细胞中的AMPK信号传导。
图4:ThIIA激活神经元细胞中的AMPK信号传导。 用施用浓度的丹参酮IIA(“ThIIA”)处理SH-SY5Y神经元细胞(A-B)或原代小鼠皮质神经元(C-D)2小时,显示总细胞裂解物中列出的蛋白质的表达(A 和C); 还测试了相对的AMPKalpha;活性(B和D)。 定量AMPKalpha;1/ ACC磷酸化(相对于总AMPKalpha;1/ ACC)(A和C)。数据表示为平均值plusmn;SD(n = 5)。*与“模拟”组相比* P lt;0.05。 #P lt;0.05与仅ODGR治疗(无ThIIA预处理)相比。该图中的实验重复三次,并获得类似的结果。
ThIIA诱导的神经保护需要AMPK的激活
为了研究ThIIA诱导的神经保护和AMPK活化之间的联系,使用shRNA方法敲低AMPKalpha;1。将两个慢病毒AMPKalpha;1shRNA与非重叠序列(S1和S2,均来自Lu博士组[34,35])直接添加到培养的SH-SY5Y细胞中。然后加入嘌呤霉素以选择稳定的细胞。定量实时PCR(qRT-PCR)测定结果证实AMPKalpha;1mRNA水平在具有AMPKalpha;1shRNA(“S1 / 2”)的稳定SH-SY5Y细胞中显着下调(图5A)。同时,AMPKalpha;1蛋白表达和ThIIA诱导的AMPK激活(由p-ACC反映)也大大受到抑制(图5B)。 AMPKalpha;1沉默的SH-SY5Y细胞更易受ODGR影响,表现出增加的生存力降低(图5C)和LDH释放(图5D)。值得注意的是,ThIIA在AMPKalpha;1沉默的SH-SY5Y细胞中几乎无效(图5C和5D)。在AMPKalpha;1shRNASH-SY5Y细胞中,ThIIA处理未能抵抗OGDR(图5C和5D)。
上
全文共23903字,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[9135],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 选择性能量转移催化烯烃的含硼几何异构化外文翻译资料
- 瑞德西韦阻滞SARS-CoV-2聚合酶的作用机理外文翻译资料
- 铱催化的共轭二烯的C-H烯基的烯丙基化反应外文翻译资料
- 铱和布朗斯特酸协同催化烯丙醇对萘酚衍生物的对映选择性脱芳构化外文翻译资料
- 新型选择性MT2受体配体2-(苯硫基)苯并[b]噻吩类化合物的制备和药理学评价外文翻译资料
- Ilimaquinone是一种海绵代谢产物,通过gadd153介导的途径发挥抗癌作用外文翻译资料
- 用环境敏感药物释放的三氧化二砷靶向介孔二氧 化硅纳米颗粒有效治疗三阴性乳腺癌外文翻译资料
- 复方中草药对雄性荷斯坦犊牛生长表现,胴体特征和肉质的 影响外文翻译资料
- 线粒体在没有人体ATP合酶的亚基c时渗透性转 变的持久性外文翻译资料
- 基于呋喃类化合物构建环氧树脂 2,5-呋喃羧酸(FDCA)生物基环氧树脂的合成及性能研究外文翻译资料


