英语原文共 8 页,剩余内容已隐藏,支付完成后下载完整资料
聚己内酯/胶原蛋白/HUCS微纤维神经导管对面神经再生的影响
Chul Ho Janga, Hyeongjin Leeb, MinSeong Kimb, GeunHyung Kim
韩国光州,全南国立大学医学院耳鼻喉科
韩国水原成均馆大学生物技术与生物工程学院生物机电工程系
文章信息:
【关键词】神经导管聚己内酯 胶原蛋白 人脐带血清 面部神经
【摘要】神经导管被用于修复神经损伤可避免神经移植中的供体部位病变。构建人工神经导管的材料包括各种生物、合成和天然材料,而本课题提出了一种新的纤维神经导管,由PCL微纤维、胶原蛋白和人脐带血清(HUCS)组成。与单纯的PCL和PCL/胶原蛋白纤维导管相比,本课题所提出的基于PCL的神经导管在体内外均表现出明显的更高的生物活性。基于本课题结果,我们认为PCL/胶原蛋白/ HUCS微纤维导管为面神经再生提供了比自体移植更有利的微环境条件,在面神经横断损伤的再生方面具有更大的治疗潜力。
- 简介
面神经功能障碍不仅会引起病人面部的明显缺陷,还会引起病人的情绪困扰。面神部经麻痹会影响病人的正常功能,如饮食。神经吻合技术和自体神经移植技术是神经再生中常用的两种技术。然而,神经吻合技术的限制在于,其仅适用于轻微缺陷或较小缺陷,且用更大的超骨耳穴神经或腓肠神经获得供体神经,而在自体神经移植后,供体神经的功能会永久性丧失,因此,神经吻合技术在临床治疗中仍面临巨大挑战。在神经切断端之间有间隙的地方,增殖的雪旺细胞从神经末梢(主要是远端)发育而来,形成有核细胞链序列,填补神经切断端的间隙。
神经导管可为神经再生提供良好的微环境,并能正确引导轴突从近端向远端萌发,对原靶细胞进行神经再生。目前,神经导管被认为是治疗神经损伤的一种替代策略。神经导管也可以用来桥接神经间隙,避免出现通常与神经移植相关的供体部位病变(感觉异常、神经瘤形成、二次切口)。各种生物组织、天然高分子材料和合成高分子材料已被广泛应用于神经导管的构建。将切断的神经末梢置入导管,导管引导轴突向远端神经残端方向生长,并作为屏障防止纤维组织浸润。理论上,导管内渗法优于suturere法。例如,受损的神经末梢不会因缝线的放置而进一步损伤。此外,神经导管有利于微环境,神经浸润在自体分泌的神经营养因子中,并允许使用外源生长因子,以促进再生或减少炎症和瘢痕。然而,相对缓慢的形态学和功能恢复,以及有限的再生距离的周围神经通过率,仍然是神经导管用于临床的阻碍。
人工神经导管的主要目的是修复神经损伤,连接切断神经的近端和远端残端。生物降解聚合物,如聚乳酸(PLA)、聚乙醇酸(PGA)、聚乳酸糖基乙酸(PLGA)和聚己内酯(PCL),能够促进神经再生,其效果可与自体移植媲美。细胞外基质(ECM)是所有组织和器官的细胞成分,由两大类生物分子组成:蛋白聚糖和纤维蛋白(即纤维蛋白),如胶原蛋白,弹力蛋白,纤维连接蛋白和层粘连蛋白。修饰支架是一种有效的外周神经修复方法,既可以提高内源性细胞在损伤部位的存活和迁移,也可以通过预加载外源性细胞到仿生管道中进行移植。
然而,天然聚合物具有较差的机械性能,会导致导管弯曲或塌陷,并在体内迅速降解;因此,聚合物需要提高支架的稳定性。PCL降解速度慢,是一种具有理想生物相容性的支架。考虑到原生ECM的结构特征,利用纳米技术,特别是纳米纤维,为组织工程应用提供更合适的人工合成基质,已成为该领域的一个重要研究方向。胶原蛋白是ECM的组分之一,有文献表明PCNF在促进骨再生方面的显著作用。
人脐带血(HUCS)含有多种生长因子(GFs),如转化GF-beta、表皮样GF、酸性成纤维细胞GF、血小板源性GF、肝细胞GF、vita- min A、P物质、胰岛素样生长因子(IGF)-1、神经生长因子(NGF)、纤连蛋白、血清蛋白-蛋白酶(A -2-大球蛋白)等。此前,有文献表明了聚己内酯/胶原纳米纤维(PCL/CoNF)联合HUCS对骨再生和骨转移再生的良好作用。
目前,对大鼠面神经横断后聚己内酯/胶原微纤维(PCL/CoMF)神经导管的作用研究还很少。本研究采用PCL/CoMF和HUCS包被的PCL/CoMF(PCL/CoMF/UCS)神经导管在体内外的方法对面神经再生进行了评价。
2.材料与方法
2.1.材料和脚手架制造
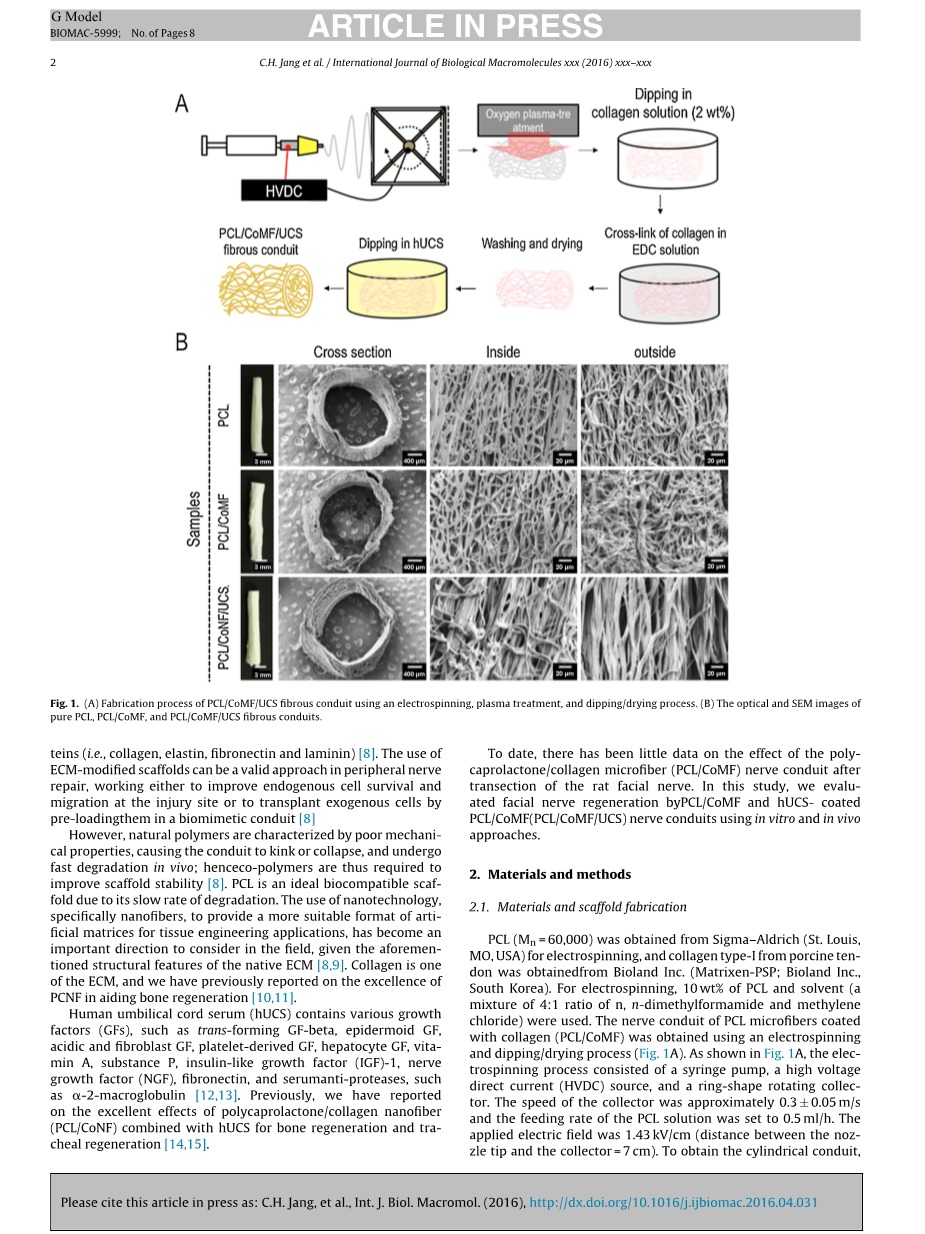
PCL(Mn = 60,000)由 Sigma–Aldrich (St. Louis, MO, USA)提供用于静电纺丝;猪肌腱的一型胶由Bioland有限公司(Matrixen-PSP; Bioland有限公司,韩国)提供。静电纺丝使用了10%质量分数的PCL和溶剂(n,n-二甲基甲酰胺:亚甲基氯=4:1)的混合物。采用静电纺丝和浸渍-干燥过程,得到了涂有胶原蛋白(PCL / CoMF)的PCL微光块的神经导管。由一个注射器泵、高压直流(HVDC)源组成,以及一个环形旋转的收集器。收集器的速度约为0.3plusmn;0.05 m/s,PCL溶液的进料速率为0.5mL/h。应用电控结果为1.43kV/cm(喷嘴和收集器的距离为7 cm)。为了获得圆柱形管道,电旋的沉积时间为2 h,在具有氧气的管道上,用氧等离子体(CUTE-MP/ R;毫微科学有限公司,韩国)处理。在血浆治疗后,管被浸入重量分数2%的胶原溶液30分钟,在室温下干燥12小时。为了使涂层胶原体交联,涂层管在室温下浸泡在50%的乙醇中,以50%的1-乙基(3-3-乙基)盐酸(EDC)溶液。在胶原蛋白交联过程结束后,用脱盐水(30分钟四次)用0.1M的 Na2HPO4洗3次,用脱盐水洗3次。在洗涤/干燥过程后,圆柱形管覆盖100mu;L的人脐带血清(HUCS)。
2.2.表面特征
采用扫描电镜(SEM, sne3000 M, SEC Inc.韩国)对纤维导管的表面形貌进行了表征。
2.3.体外试验
用70%乙醇和紫外光对制备的圆柱形导管进行杀菌处理,置于培养基中过夜。然后将标本在汉克平衡盐溶液中预热4小时。大鼠嗜铬细胞瘤细胞(PC-12, ATCC)在杜尔贝科改良的伊戈尔培养基(DMEM, Hyclone)中培养,加入10%胎牛血清(FBS, Hyclone)和1%青霉素/链霉素(Hyclone)。PC-12细胞被播种在每个5times;8 mmsup2;纤维垫密度为1times;10circ;4细胞每标本和37◦C培育在5%的二氧化碳大气中。培养基每隔一天就更换一次。
用MTT法(细胞增殖箱 I, Boehringer Mannheim, Mannheim, 德国)测定活细胞的增殖。该方法是利用线粒体脱氢酶将黄色四唑盐(MTT)裂解到活细胞中产生紫色的福尔马赞晶体。在37◦C,0.5 mg/mL-1 MTT缓冲4小时,在570nm处使用微平板阅读器(EL800;Bio -Tek仪器,Winooski, VT)。每个潜伏期检测5个样本,每次检测一式三份。
细胞培养1天和3天后,将培养的细胞分别置于0.15 mM 钙黄绿素和2mm 溴乙啡锭二聚体孵育箱中培养45min,观察活细胞和死细胞。显微镜下观察染色标本(TE2000-S;尼康,东京,日本)配备了荧光附着体和SPOT RT数码相机(SPOT Imaging Solutions, Sterling Heights, MI, USA)采集彩色图像;绿色和红色分别表示活细胞和死细胞。ImageJ软件(美国国立卫生研究院,贝塞斯达,MD)被用来计数活细胞。
细胞培养7天后,将标本细胞亚注入二苯胺-2-苯林德(DAPI)荧光染色检测细胞核,采用鬼笔环肽(Invitrogen, Carlsbad, CA, USA)染色观察细胞的纤维状肌动蛋白细胞骨架。然后用荧光显微镜观察染色标本。
2.4.体内试验
2.4.1.手术
采用16只雄性斯普拉格-道利大鼠(体重250-300克),检查其耳膜正常。动物随机分为实验组和对照组(n = 8)。在恒温2℃◦,湿度50%,环境噪声水平lt; 40db的房间中安置大鼠。所有动物实验都遵循韩国全南国立大学动物实验委员会(CNU IACUC-H-2013-16)批准的方案。大鼠经腹腔注射佐乐替reg;(替乐他明与佐乐西泮、Virbac、Carros、法国)和盐酸西拉嗪1:1组合麻醉。左侧作耳后切口。在操作显微镜下(徕卡M300;(德国耶拿,恩斯特-莱茨街),面神经的主干暴露在茎突孔的出口,在主干分支之前。通过对整个半面部运动的电刺激,确定了主干。用离主干2 mm的微血管剪刀切断主干,收缩后形成约4 mm的神经间隙缺损。对照组(n = 8)用两根缝线将PCL/CoMF神经导管接于近端和远端残端之间。实验组(n = 8)移植PCL/CoMF/UCS神经导管。两组被试的神经导管末端均用纤维蛋白胶密封,导管表面覆盖可生物吸收的间隙孔(荷兰格罗宁根的Polyganics公司),用生理盐水浸泡,防止周围粘连。
2.4.2.触须搅拌评价
术后第2周、第4周、第6周和第8周,通过测量振动运动来评估功能恢复情况。通过比较同侧一侧的运动与受损神经的运动与完整的对侧一侧的运动,使用Gilad任意评分的修正版本,监测振颤功能的恢复(0,完全瘫痪,振颤平,后向;1、轻微颤动的震动动作;2、更现代的颤振运动;3、运动颤抖但方向异常;4、尾振肌运动明显正常,但方向仍不正常;5、运动充分,方向正常)。
2.4.3.电生理检测
电生理分析在手术前和术后各时间点进行。在该测试中,动物被放置在一个侧面的位置,体温主要是在恒温垫保持37℃。通过锁骨下切口再次显露左侧面神经。近端主干在茎乳孔被检测到。一个单极激励电极(Xomed-Treace, Jacksonville, Florida, USA)连接到一个脉冲发生器(A- 320d, 世界精细仪器 有限公司)。然后将电信号(0.05毫秒的矩形电流脉冲)传送到面神经的主干。采用微机械臂固定单极激励电晶体。为了实现局部刺激,除了末端的0.5 mm球体外,整个探头和柔性导线都进行了绝缘。为了记录电诱发肌动作电位(EMAP)信号,将针电极经皮插入左侧眼轮匝肌中点。第二针电极置于皮下,位于左侧口轮匝肌上方。一个接地针电极被插入皮肤附近的浅表肌层。所有EMAP均采用超最大神经刺激法获得,数据采集采用采集系统(PowerLab, AD仪器,Castle Hill, 澳大利亚)数字化,并在计算机显示器上播放,使用Scope软件(AD仪器,Castle Hill, 澳大利亚)进行分析。测量动作电位波形的峰值振幅和潜伏期,以评估面神经损伤后的恢复情况。
2.4.4.组织病理学观察
电生理后,每组对5只动物进行无痛致死手术,取组织用4%的聚甲醛固定过夜。在固定后,样品被移动到30%蔗糖在PBS溶液中,在4◦C最多3天,之后样品被嵌入OCT化合物(组织Tek)和冷冻冷冻切片。使用徕卡CM1950低温恒温器(德国徕卡、维茨拉尔), 8 - 14micro;m厚的部分从纵向切割部分神经和免疫组织化学染色神经纤进行评估组织形态和再生轴突的存在(1:500,NF160 Abcam)和S-100(默克密理博,达姆施塔特,德国)。免疫组切片用0.1%皂素PBS冲洗,室温下用4%正常山羊血清(NGS)、1%牛血清白蛋白(BSA)、0.1%皂素组成的封闭液孵育1 h。在阻断液中重组一次抗体,应用于切片。部分然后孵化过夜在4◦C。应用二抗前,用0.1%皂素PBS冲洗标本。切片在二抗(Alexa Fluor546山羊抗兔IgG)稀液中室温孵育1 h。
安乐死后,对每组3个动物的远端神经进行迅速切除,立即浸入4%多聚甲醛,2.5%戊二醛(Sigma-Aldrich, St. Louis, MO)0.1M磷酸盐缓冲液,pH 7.4, 温度4℃,12 h,保持标本伸展和定向。固定后在磷酸盐缓冲液中冲洗组织样品,室温下1%四氧化锇(OsO4;E.M.S.然后脱水,首先是乙醇系列,最后是丙烯。然后将组织样本嵌入树脂混合物中。在粉碎点远端5mm处切取半薄横切面,玻片上用甲苯胺蓝染色。切片用光学显微镜观察。使用超原子超微球III(LKB, Bromma, Sweden)完成一系列半薄切片后立即进行超薄切片。然后用JEM-1010透射电镜(日立H-7600;日立、日本东京)。采用图像分析软件(image Inside software, Focus Co.,Daejeon,韩国)获得有髓轴突计数和髓鞘厚度。
3.结果
3.1.预制导管的表面形貌
下图为纯PCL、PCL/CoMF、PCL/CoMF/UCS导管的光学和SEM显微图。扫描电镜(SEM)图像显示,圆柱体导管内外表面形态相似,纤维结构随机分布于导管外。纤维组成的管道的直径是2.19-1.31micro;m。胶原蛋白和UCS留在表面的装配式管道分别在2.8plusmn;0.1micro;g/cmsup2;, 1.4plusmn;0.1micro;g/cmsup2;浓度进行。
3.2.利用PC12细胞对导管的体外活性(活/死、细胞增殖和DAPI/鬼笔环肽)进行了研究
为评价PC12细胞的体外活性,分别在纯PCL、PCL/CoMF、PCL/CoMF/UCS纤维导管上进行培养。下图显示了分别培养1天、3天的PCL、PCL/CoMF和PCL/CoMF/UCS纤维垫的活/死细胞荧光图像。图像上的绿色和红色表示活细胞和死细胞。如图所示,PCL/CoMF和PCL/CoMF/UCS纤维垫上的活PC-12细胞明显高于单纯的PCL对照组。
为了观察纤维垫上活细胞在每个时间点(1,3,7天)的增殖情况,采用MTT法。下图为MTT结果:所有纤维支架的细胞增殖均随培养时间的延长而增加。然而,PCL/CoMF/UCS上存活细胞的增殖率在所有测量日均显著高于PCL和PCL/CoMF mat。这可能与HUCS中多种有效的生物生长因子有关。<!--
全文共7005字,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[399],资料为PDF文档或Word文档,PDF文档可免费转换为Word
以上是毕业论文外文翻译,课题毕业论文、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。
您可能感兴趣的文章
- 选择性能量转移催化烯烃的含硼几何异构化外文翻译资料
- 瑞德西韦阻滞SARS-CoV-2聚合酶的作用机理外文翻译资料
- 铱催化的共轭二烯的C-H烯基的烯丙基化反应外文翻译资料
- 铱和布朗斯特酸协同催化烯丙醇对萘酚衍生物的对映选择性脱芳构化外文翻译资料
- 新型选择性MT2受体配体2-(苯硫基)苯并[b]噻吩类化合物的制备和药理学评价外文翻译资料
- Ilimaquinone是一种海绵代谢产物,通过gadd153介导的途径发挥抗癌作用外文翻译资料
- 用环境敏感药物释放的三氧化二砷靶向介孔二氧 化硅纳米颗粒有效治疗三阴性乳腺癌外文翻译资料
- 复方中草药对雄性荷斯坦犊牛生长表现,胴体特征和肉质的 影响外文翻译资料
- 线粒体在没有人体ATP合酶的亚基c时渗透性转 变的持久性外文翻译资料
- 基于呋喃类化合物构建环氧树脂 2,5-呋喃羧酸(FDCA)生物基环氧树脂的合成及性能研究外文翻译资料