
英语原文共 5 页,剩余内容已隐藏,支付完成后下载完整资料
生物质衍生碳水化合物生产液体燃料用二甲基呋喃
化石燃料储量的减少和对全球变暖的日益关切表明,不久的将来就需要可持续的能源。使燃料在运输系统中发挥作用,它们必须具有特定的物理特性,以便有效地分配、储存和燃烧;这些特性目前由不可再生的石油衍生液体燃料来实现。乙醇是目前唯一大量生产的可再生液体燃料,它存在一些限制,包括能量密度低、挥发性高和被吸收物污染。大气中的水离子。在这里,我们提出了一种催化策略,从果糖(一种直接从生物质或异构化得到的碳水化合物)生产2,5-二甲基呋喃。葡萄糖)用作液体输送燃料。与乙醇相比,2,5-二甲基呋喃具有更高的能量密度(40%),更高的沸点(20K),并且不溶于水。这一催化战略为将丰富的可再生生物质资源转化为适合运输部门的液体燃料开辟了一条道路,并可能减少我们对石油的依赖。
碳水化合物转化为2,5-二甲基呋喃(DMF)的基本原理可表述如下.从己糖(例如果糖)中选择性地除去五个氧原子,不仅产生DMF将沸点降低到一个适合液体燃料的值,但同时也达到单氧C6化合物的最低水溶性和最高研究辛烷值3(RON)。LE保持较高的能量密度(30 kJ cm~(23)。这种选择性去除氧原子可分为两步:第一步,脱水除去三个氧原子,生成5-羟基甲醚。第二,通过氢解除去两个氧原子,通过中间产物4和5生成DMF。物种6,以7的方式产生,是一种氢解副产物,也是一种氢解副产物。具有优良的燃料品质。
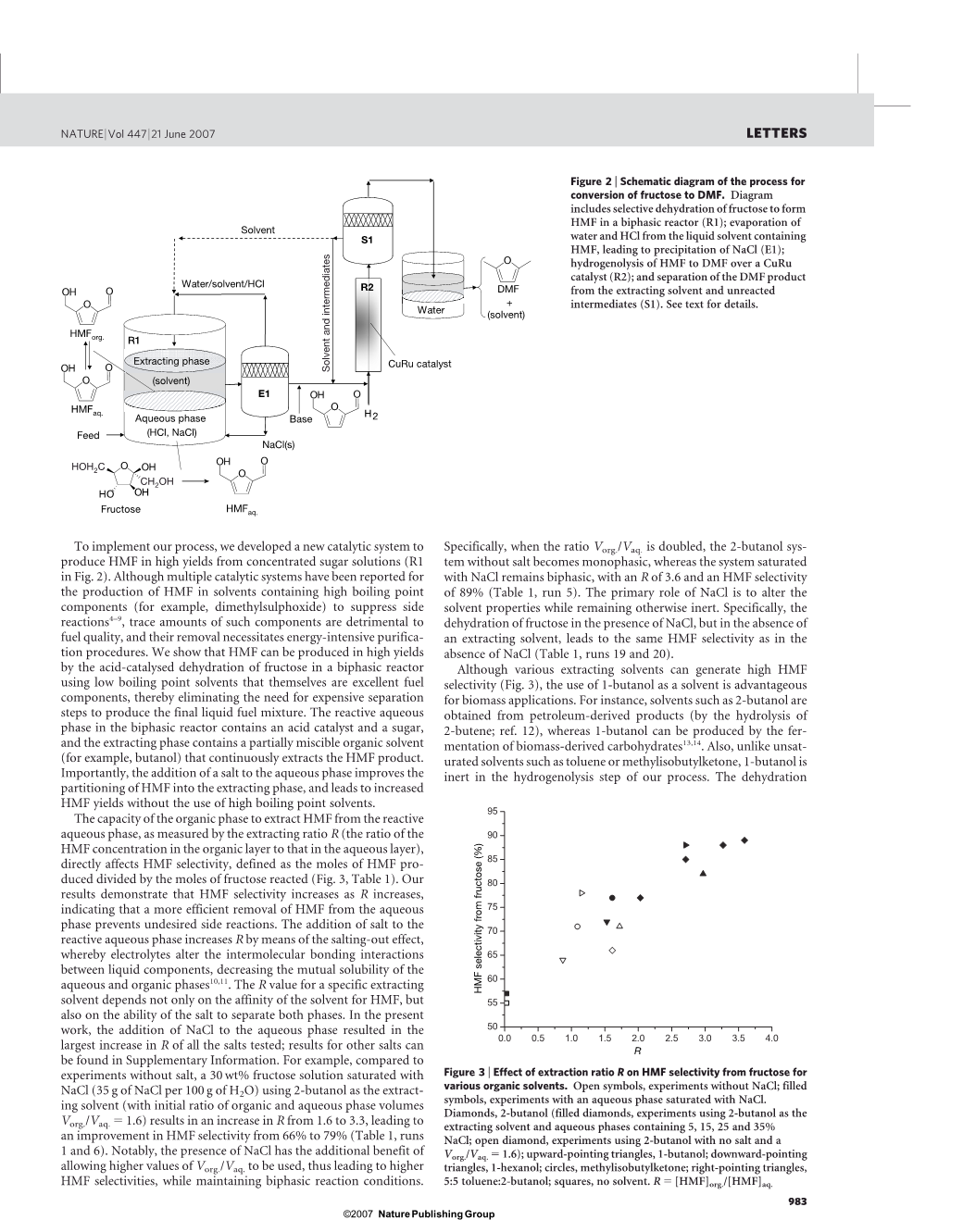
为了实现我们的工艺,我们开发了一种新的催化系统,从浓缩糖溶液中生产高收率的HMF。虽然已报告了多种催化系统f或在含有高沸点组分(例如二甲基亚砜)的溶剂中产生hmf以抑制副反应,这些成分的微量对f是有害的。UEL的质量和它们的去除需要能量密集的净化程序.结果表明,果糖在两相反应中经酸催化脱水,可获得较高产率的HMF。或者使用低沸点溶剂,这些溶剂本身就是优良的燃料组件,因此不需要昂贵的分离步骤来生产最终的液体燃料混合物。反应性两相反应器中的水相含有酸催化剂和糖,萃取相含有部分可混溶的有机溶剂(如丁醇),可连续萃取。这是HMF产品。重要的是,在水相中加入盐可改善HMF在萃取相中的分配,并在不使用高沸点的情况下提高HMF的产量。
有机相从反应水相中提取HMF的能力,用萃取比R(有机层HMF浓度与水相HMF浓度之比)来衡量。(s层),直接影响HMF的选择性,定义为果糖反应的摩尔除以产生的HMF。我们的结果表明,HMF选择性增加了r增加,表明从水相中更有效地去除HMF可以防止不良的副反应。反应水相中盐的加入通过TH增加R。盐析效应,即电解质改变了液体组分之间的分子间键作用,降低了水相和有机相的相互溶解度。Rva对于特定的萃取溶剂,LUE不仅取决于溶剂对HMF的亲和力,还取决于盐对HMF和HMF的分离能力。在本工作中,NaCl的加入对水相而言,所有被测盐类的R值增加幅度最大;其他盐类的结果见“补充资料”。例如,与没有盐,以2-丁醇为萃取溶剂(有机相和水相体积比为Vorg./VAQ)的30%果糖溶液,以NaCl(每100 g H2O中35克NaCl)饱和。5 16)R从1.6增加到3.3,使HMF选择性从66%提高到79%(表1,运行1和6)。值得注意的是,NaCl的存在对al有额外的好处。Vorg./VAQ值较高。用于,从而导致较高的HMF选择性,同时保持两相反应条件。具体来说,当Vorg./VAQ。是双倍的,2-但是.不含盐的醇体系为单相,饱和NaCl的体系为两相体系,R为3.6,HMF选择性为89%(表1,运行5)。NaCl的主要作用是改变溶剂性质,同时保持惰性。具体来说,果糖在NaCl存在下脱水,但在没有萃取溶剂的情况下,在没有NaCl的情况下会导致相同的hmf可选性。
虽然不同的萃取溶剂都能产生较高的HMF选择性,但使用1-丁醇作为溶剂有利于生物质的应用。例如,2-丁醇等溶剂。从石油衍生产品中得到(通过2-丁烯的水解);而1-丁醇则可由生物质衍生碳水化合物(13,14)发酵产生。而且,不像非卫星组织1-丁醇作为甲苯或甲基异丁基酮等溶剂,在我们的氢解过程中是惰性的。1-丁醇与NaCl水相的脱水反应R值为3.0,HMF选择性为82%。当使用1-丁醇时,我们观察到hmf s。在盐酸浓度从0.01到0.25M的范围内,选择性与酸含量无关。
含有HMF的提取溶剂接下来经历了一个纯化步骤。对于类似于运行12的实验,进入蒸发器的流包含260 mmol L21 HM。F(用高效液相色谱法测定),2,800 mmol l21水,26 mmol L21 NaCl(用高效液相色谱法测量),3.6 mmol L21HCL(用NaOH酸滴定法测定)和1.1 mmol L21-1-氯丁烷(用气相色谱法测定)。真空低温蒸发(例如363 K)可用于分离。相对挥发度较低的组分如HMF和1-丁醇中的TE挥发性杂质。此外,由于NaCl在无水有机溶剂中的溶解度低于水,所以Re水的运动使盐从溶液中沉淀出来。蒸发占入流总质量的25%,使杂质含量降至360 mmol L21水,1.6mmol L21 NaCl,1.5m。mol L 21 HCl和0.2mmol L 21 1-氯丁烷.1-氯丁烷的含量低于我们的检测限值(0.1 mmol L 21),方法是用NaOH中和离开蒸发器的净化流。ATOR。这样,水,氯化钠,蒸发的1-丁醇的分数,和58%的盐酸被回收和回收回两相反应器,而净化的液体流含有。HMF和1-丁醇被送往进一步加工。
接下来,HMF在铜基催化剂上转化为DMF.先前的研究表明,铬酸铜(CuCrO 4)选择性地将糠醛转化为7和6,而没有过多的Hid。呋喃环的再生或过度分解产物15-17。因此,CuCrO 4应该是氢解hmf制dmf的有效催化剂,尽管对此没有任何研究。已经有报道。用CuCrO 4进行HMF氢解的液相间歇实验表明,DMF的收率为61%(定义为选择性和转化率的产物),5%的收率为29%。详细结果见补充资料)。然而,重要的是,溶剂中微量的氯离子(在脱水过程中引入,而不完全去除Du)。使CuCrO 4催化剂失活。例如,在含有1.6 mmol l21氯化钠的1-丁醇溶液中使用这种催化剂时,dmf的收率只有6%。获得。文献报道了铜基催化剂在铜基催化剂上的失活现象。氯离子的含量表明,失活的主要方式是氯化物诱导的Co烧结。
为了减轻铜催化剂的中毒,我们研制了一种抗氯化物的碳载铜钌催化剂.使用这种催化剂的理由是我们第一次观察到在氯离子存在下,碳负载钌催化剂具有抗失活能力;然而,这种催化剂主要将HMF转化为8。因为铜和钌与钌相比,铜的表面能较低,它们的混合物形成了一个两相体系,其中铜相包覆了钌相19-21的表面。因此,我们认为研究表明,Curu/C催化剂在抗钌氯的同时,可能表现出类似铜的氢解行为。
采用3:1(原子比)Cu:RU/C催化剂进行液相氢解实验,产率分别为71%DMF、4%6和12%中间体。值得注意的是,同样的催化剂与纯化的1-丁醇一起使用。含有1.6mmol L21 NaCl的溶液可产生61%DMF、4%6和20%的中间体。因此,尽管Curu/C在某种程度上受到氯化物存在的影响,但它的性能明显优于CuCrO 4。
另外,由于NaCl不蒸发,用流动反应器进行了气相氢解实验,以消除氯离子对Curu/C相氢的影响。使用3:2 Cu:Ru/C催化剂的收率为76-79%DMF,1.5%和10 wt%的HMF原料为5%的中间体(见关于详细结果的补充资料)。反应后未检出氯化烃。因此,尽管汽相过程需要对进料进行汽化,但它提供了多个好处。首先,与液相法相比,它不产生副产品,产生的中间体也较少.第二,它既可以处理稀释的HMF溶液,也可以处理浓缩的HMF溶液。第三,因为当使用1-丁醇或1-己醇时,产率相同,其他溶剂可以在不改变选择性的情况下使用。最后,虽然催化剂经过处理后缓慢失活HMF的质量相当于催化剂质量的1.7倍,在反应温度下可以通过氢的流动完全再生。
在钌催化剂上,DMF可以选择性地加氢成9。9含有比DMF更高的氢碳比,转化为更高的能量含量。此外,9可提供额外的长期储存的稳定性,因为它含有一个完全氢化的呋喃环。DMF和9的毒理学特性都没有经过彻底的测试。极限者现有资料表明,DMF的毒性并不比目前的燃料组件更大;然而,在批准这些呋喃组件用于商业用途之前,必须进行长期研究。(详情见补充资料)。
最后一步涉及从溶剂和反应中间体中分离DMF(。较易挥发的成分(即DMF,6和水)可以从溶剂中分离出来。以及中间产物,后者可以被回收回氢解反应器。在缩合反应中,疏水产物DMF和6自发地与水分离。取决于根据燃料组成的最终要求,蒸馏过程可以更精确地控制组分的分布,也可以回收一部分溶剂进行脱水。n反应堆。我们注意到,蒸发含有dmf和1-丁醇的气流所需的能量,导致产品分离,大约是蒸发aq所需能量的三分之一。用于生物燃料的发酵生产的乙醇溶液(见补充资料)。
如果使用更易获得的原料,如葡萄糖,那么从生物质大规模生产DMF的效率就会提高。虽然我们直接获得了中等的hmf产量。从葡萄糖(表1,运行22),果糖的转换是更有选择性的。在这方面,已经存在从葡萄糖中产生高水平果糖的有效过程,如酶学。异构化结合模拟移动床分离22,23。尽管商业应用仍然面临挑战,但这项研究为生产DMF作为一种生物物质开辟了一条新的道路。衍生液体运输燃料。
方法摘要
脱水实验。在一个典型的实验中,一种含己糖的水溶液(例如,30%的无盐果糖),一种无机盐(例如,氯化钠),一种酸性催化剂(Fo)。r例,0.25 M HCl)和有机溶剂(如1-丁醇)混合在厚壁玻璃反应器中。反应是在453 K,在蒸汽产生的总压力下进行的。在此温度下,挥发性组分的r压力以及有机相和水相的初始体积比为常(Vorg./VAQ.)。反应时间约为3分钟。75%的饲料。
氢解实验
在493 K和6.8 bar H2压力下,用质量分数为5%的HMF在1-丁醇溶液中进行了液相氢解实验。进行了气相实验。在493 K的流动反应器中,液体进料速度为0.2 cm3 min 21,每小时空速(定义为每克催化剂每小时HMF克)为0.15 H21,1.5w为0.98 H21。t%和10 wt%HMF溶液分别在1-丁醇中.采用初湿浸渍法制备了Curu/C催化剂(定义为含有金属的浸渍液的条件)。在碳(C-10催化剂浓度)上添加10 wt%Ru的工业催化剂,加盐填充催化剂载体的孔体积,相当于每克催化剂1.06毫升。NG的高性能钌对VulcanXC 72碳,E-TEK部门,PEMEAS燃料电池技术)与硝酸铜(CuNO3 .2.5H2O,Sigma-Aldrich)水溶液。
方法
脱水反应。水相和有机相组分,包括反应物(果糖和葡萄糖)、无机盐(NaCl、KCl、NABR、KBr、Nano 3、Na2SO4、Na2HPO4、CaCl 2、CSCL和MgCl 2)、有机化合物从Sigma-Aldrich得到C溶剂(2-丁醇、1-丁醇、MIBK、甲苯和1-己醇)和盐酸催化剂.
在10毫升的厚壁玻璃反应器(Alltech)中进行了间歇催化实验,该反应器被放置在磁力搅拌器上的控温油浴中加热。油中的温度L浴用K型热电偶(Omega)测量,采用16A系列温度控制器(Dwyer仪器)与150 W加热盒(McMaster Carr)耦合控制。在一个典型实验,1.5g的0.25MHCl水溶液由30%的果糖(无盐基)和一定量的萃取溶剂组成,以保持Vorg./VAQ=3.2被倒进Rea克托。在使用前,在脱水反应器中,萃取溶剂与含有相同盐量的水相预接触。这样,提取的phaE在反应前被水和盐浸透。反应器放置在353 K的预热油浴中2分钟,然后转移到453 K的油浴中进行反应。n.反应时间为2.5~3 min,转化率接近75%。该反应在253 K的乙二醇浴中冷却,停止了反应,然后在分离时,质量和测量了两相的密度。每个相的密度值是通过称重恒定体积来测量的。
使用配备PDA 960 UV(320 Nm)和RI-410折射率检测器的Waters 2690系统,采用高效液相色谱法进行样品分析。用氨基Hpx-87H监测果糖的消失。色谱柱(Biorad),以MilliQ水(PH 2)为流动相,流速为0.6ml min 21,柱温333 K,用Zorbax测定了HMF在水相和有机相中的含量。SB-C18反相柱(Agilent),采用2:8v/v甲醇:水(PH 2)梯度,流速0.7 ml min 21,柱温308 K。
根据HPLC法得到的水相和有机相浓度的产物及其反应后的体积,计算果糖转化率和HMF选择性。
脱水反应后,采用组合工艺测定了有机层的杂质含量。用氨基酸hpx-87H柱测定氯化钠的含量。用NaOH酸滴定法测定氮含量;气相色谱法测定1-氯丁烷含量(岛津GC-2010用FID检测器和Alltech的DB-5柱)。含水量纯化前、后均采用质量平衡法进行纯化。特别是,考虑到所有成分的初始数量,以及水和有机物质的最终质量。在水相层(HPLC)中,有机溶剂的相和浓度可以计算出萃取溶剂中的水分含量。例如,在混合了5克水后在无水正丁醇10 g NaCl的作用下,有机层质量为10.6g,水相层中存在0.06g正丁醇。那么,假设一个疏忽当NaCl进入有机层时,在10.6g萃取溶剂中,有机层含水量为0.66g,提取溶剂为2800mmol/l。在类似的方式,提取溶剂在净化步骤后的剩余水量可以通过减去从蒸发器中回收的水量来计算。蒸发前提取溶剂中的水分含量。
氢解反应:催化剂制备
采用预湿浸渍法制备了CURU/C催化剂(C-10:Hp钌,VulcanXC-72,E-TEK,PEMEAS燃料电池技术)。硝酸铜(CuNO3 .2.5H2O,SigmaAldrich)水溶液。对于典型的3:2(摩尔比)Cu:RU催化剂,在5g去离子水中溶解1.55g硝酸铜。阿特。然后将
全文共6937字,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[873]


