应用于原位肝癌的 近红外二区光热治疗的特制半导体聚合物外文翻译资料
2022-08-08 19:58:04

英语原文共 10 页,剩余内容已隐藏,支付完成后下载完整资料
应用于原位肝癌的
近红外二区光热治疗的特制半导体聚合物
摘要:由于手术切除率低,复发率高和侵袭性,肝肿瘤是最致命的癌症之一。而光照疗法(PTT) 的非侵入性在癌症治疗方面有许多优点。可是,绝大多数光照疗法在近红外一区进行,因此,具有较高穿透力和临床应用前景的近红外光敏剂是非常理想的。本文中,采用三元共聚方法,获得了在近红外一区和近红外二区具有最佳吸收性能的半导体聚合物。该半导体聚合物制备的纳米粒子将用于激光治疗原位肝癌。实验中,与808 nm激光相比,1064 nm激光在相同条件下对原位肝癌有更有效的抑制作用。因此,这些结果表明,近红外二区聚合物纳米颗粒对各种原位癌的高效治疗有一定积极影响。
关键词:近红外二区、半导体聚合物、有机纳米颗粒、原位肝癌、光热治疗
肝细胞癌(HCC)是最常见的原发性肝癌,是全球第二大癌症死亡原因。[1-3]治疗肝细胞癌的选择有很多,[4-8]然而令人失望的是,大多数治疗方法很难治愈肝细胞癌,预后诊断尚不乐观。[9,10]肝癌手术切除率低、复发率高的主要原因是很多肝癌患者在手术中已经有肝内微转移,或者是术后残留的病灶导致。[10]姑息性肝切除术可促进剩余肝内肿瘤细胞的生长和扩散,术后需积极干预以提高其治疗效果。此外,对于恶性程度较高的浸润性肝癌,癌块无明显边界,进展迅速,因此在发现时往往无法彻底切除。因此,为了提高肝癌的治疗效果,除了促进早期发现和治疗外,更重要的是探索更有效的治疗方法。
近年来,光热疗法(PTT)在灭杀肿瘤方法中有突出优势,它在时间和空间上的精确把握,对正常组织无明显损伤,且不会产生明显的抗药性,引起了研究者的广泛关注。[11-20]光热疗法中使用的激光通常位于近红外区域,在“生物窗口”中更透明,对正常组织的伤害更小。[21-25]除了近红外一区的光学窗口(750-1000 nm)用于光热疗法,[26-30]光热疗法在近红外二区(1000-1700 nm)的应用也引起了越来越多的关注。[11,15,31-41]为了减轻光热疗法中光的衰减,最好使用1064 nm的激光代替808 nm的激光,因为1064 nm的激光可以穿透更深的组织(图1a),[42,43]并且最大允许激光功率(1 W cmminus;2)高于808 nm激光最大允许激光的功率(0.33 W cmminus;2)。[44-46]尽管在近红外二区的光热疗法和光学成像方面已经取得了一些重大进展,[11,15,32,38-41,47-58]但真正对原位肿瘤有用的光热疗法仍是罕见的。最近,Liu的团队报道了近红外二区型光热疗法在深部原位脑瘤中的应用,[11]然而,利用近红外二区型光热材料治疗其他肿瘤的研究尚未开始。
在此,为了治疗原位肝癌,我们精心设计合成了一种在近红外二区光学窗口具有最佳吸收的半导体聚合物。聚合物基纳米粒子(NP)在水中具有良好的分散性,可以在肿瘤部位具有较好的聚集,因此被开发出来。实验以近红外一区(808 nm)激光为对照,详细研究了近红外二区(1064 nm)激光照射下纳米粒子的光热转换行为和光热疗法效果(图1a)。
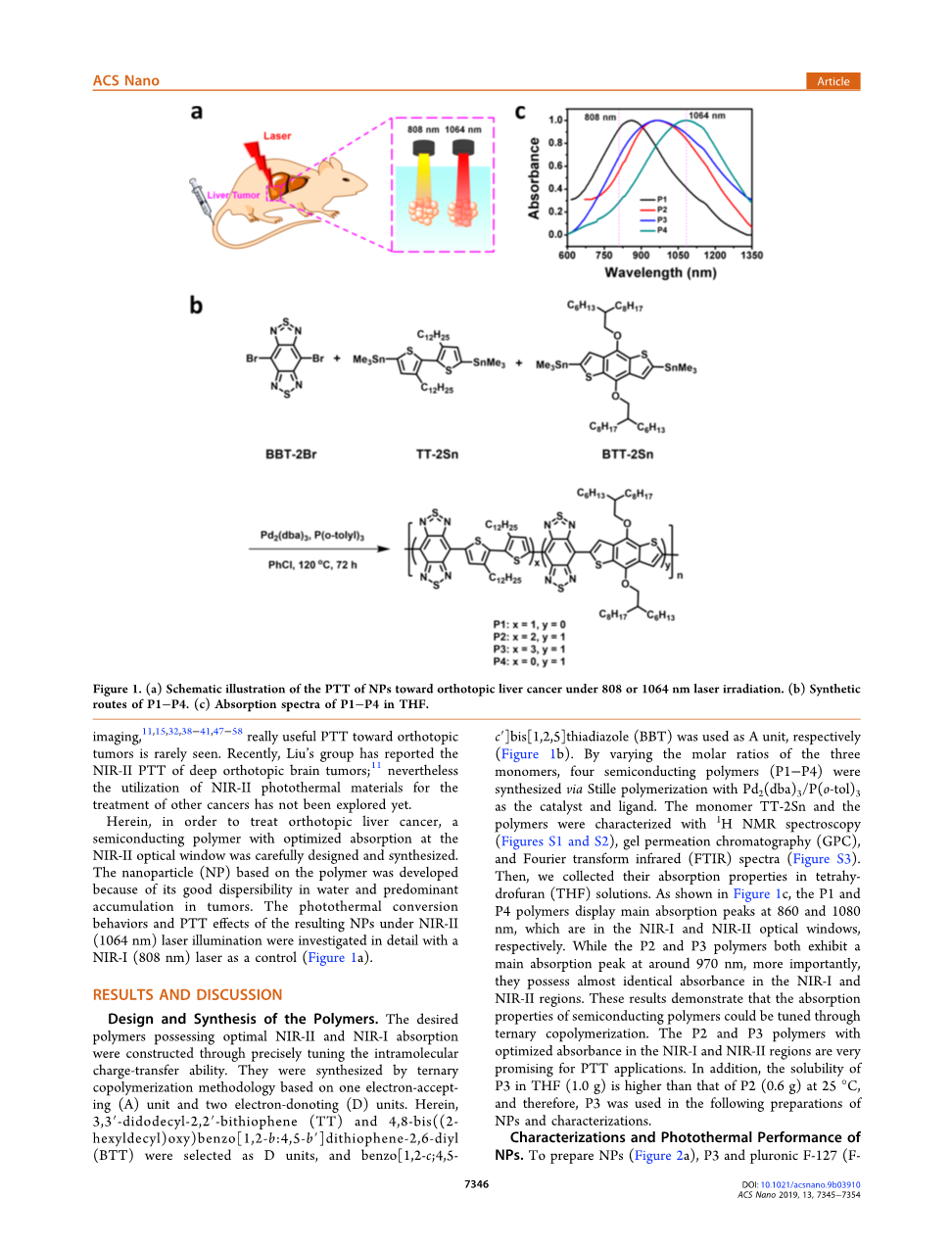
图1.(a)光热纳米粒子在808或1064 nm激光照射下对原位肝癌的光热治疗的示意图。(b)聚合物1-4的合成路径(c)P1-P4在四氢呋喃中的吸收光谱
结果与讨论
聚合物的设计和合成。通过精确调节分子内电荷转移能力来构建具有最佳近红外二区和近红外一区吸收率的所需聚合物。它们采用三元共聚方法合成,即以一个电子接受单元(A)和两个电子取代单元(D)为基础。其中,分别以3,3-二十二烷基-2,2-双噻吩(TT)和4,8-双((2-己基癸基)氧基)苯并(1,2-b:4,5-b)二噻吩-2,6-二基苯并(BTT)为D单位,苯并(1,2-c;4,5-c)双噻唑(BBT)为A单位(图1b)。通过改变三种单体的摩尔比,以Pd2(dba)3/P(o-tol)3为催化剂和配体,通过静态聚合合成了四种半导体聚合物(P1-4)。用核磁共振氢谱(图S1和S2)、凝胶渗透色谱(GPC)和傅里叶变换红外谱(FTIR)(图S3)对单体TT-2Sn和聚合物进行了表征。然后,我们收集了它们在四氢呋喃(THF)溶液中的吸收特性。如图1c所示,P1和P4的主要吸收峰分别出现在860 nm和1080 nm处,分别位于近红外一区和近红外二区光学窗口。虽然P2和P3的主要吸收峰都在970 nm左右,但更重要的是,它们在近红外一区和近红外二区的吸光度几乎相同。这些结果表明,半导体聚合物的吸收性能可以通过三元共聚来调节。在近红外一区和近红外二区具有最佳吸光度的P2和P3聚合物在光热疗法应用中很有前景。此外,在25℃时,P3在四氢呋喃(1.0 g)中的溶解度高于P2(0.6 g),因此,P3被用于纳米粒子的制备和表征。
图2.光热纳米粒子的基本特性和光热性能。(a)光热纳米粒子的制备原理图。(b)光热纳米粒子的透射电镜图像和动态光散射结果(inset)。(c) P3在四氢呋喃和光热纳米粒子在水中的吸收光谱。(d)不同浓度纳米粒子在1064 nm激光照射下(1.0 W cmminus;2)10 min的光热转换行为。
纳米粒子的表征与光热性能。制备纳米粒子(图2a)时,将P3和pluronicF-127(F127)溶于四氢呋喃中,经超声处理后分散于水中。在四氢呋喃蒸发和透析后,用动态光散射(DLS)和透射电镜(TEM)对纳米粒子进行了表征。纳米粒子的流体动力学直径约为70nm,多分散性指数为0.13,与透射电镜图像中的球形纳米颗粒一致(图2b)。根据透射电镜中P3的标准曲线(图S4),P3在纳米粒子中的载荷含量和效率分别为19.3%和89.6%。在水中储存100天后,纳米粒子的粒径和粒径分布基本保持不变(图S5a)。从图S5b可以看出,纳米粒子在含10%胎牛血清(FBS)的磷酸盐缓冲生理盐水(PBS)溶液中也是稳定的,说明纳米粒子在水和生理条件环境下具有良好的稳定性。在图2c中,纳米粒子在水中从近红外一区到近红外二区表现出广泛的吸收,在四氢呋喃中相对于P3聚合物的红移约为85nm,这应该归因于P3聚合物的聚集。纳米粒子在808 nm和1064 nm水中的消光系数分别为13.2和17.3 Lgminus;1 cmminus;1,这可能因为粒子在808 nm和1064 nm激光照射下提供了光热转换能力。
接下来,我们详细比较了纳米粒子在808 nm和1064 nm激光照射下的光热性能。当808 nm和1064 nm激光的功率密度维持在1.0 W cmminus;2中,可以观察到一个显著的密度依赖性的温升(图S6和2d),在波长为1064 nm的激光辐照下纳米粒子的温升速度比在波长808 nm的激光辐射下要快。从图2e中还可以看出,在1064 nm激光辐照下20 mu;g mL-1处的纳米粒子的温度升高程度与在808 nm激光辐照下30 mu;g mL-1处的纳米粒子的温度升高程度相当。而且,纳米粒子的温度升高也具有浓度依赖性的趋势,如图S7所示。参照先前的方法,[59-61]在808 nm和1064 nm激光辐照下,纳米粒子的光热转换效率(eta;)分别为31.1 %(图S8)和46.0 %(图S9),进一步证明了纳米粒子在激光辐照下出色的光热性能;纳米粒子的光热稳定性通过加热-冷却的重复循环得以验证。如图S10所示,经过6个循环后,温度升高保持不变。纳米粒子在肿瘤光热疗法中的应用离不开其良好的光热转换性能和稳定性。用红外光穿透厚度不断增加的鸡组织后可以发现,在1064 nm激光照射下,光热纳米粒子的温度下降比在808 nm激光照射下(图S11)的温度下降慢(图S11),证明了光热治疗中1064 nm激光比808 nm激光具有更优越的光热性能。[11,62]
纳米颗粒对癌细胞的细胞摄取和细胞毒性。有效的细胞摄取是纳米颗粒发挥治疗作用的前提,因此将环境依赖性染料尼罗红(NR)装入纳米颗粒中制备NR@NPs。[63]通过共聚焦激光扫描显微镜(CLSM)观察人肝癌(HepG2)细胞对NR@NPs的吸收。在NR@NPs孵育0.5和2小时后,人肝癌细胞均可见明显的红色荧光,红色荧光强度从0.5到2小时逐渐增强(图3a)。高效的细胞摄取为纳米粒子发挥光热治疗奠定了基础。为了探索纳米粒子作为光热剂在癌症光热治疗中的应用,我们首先通过3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化铵(MTT)实验研究了人肝癌细胞的存活率(图3b)。用不同浓度(0-40 mu;g mL-1)的纳米粒子处理细胞,然后用808 nm或1064 nm激光照射,并将未照射的细胞用作对照。对于没有激光照射的细胞,培养24小时后未观察到明显的细胞毒性。然而,对于经历激光照射(1.0 W cm-2,10分钟)的细胞,细胞活力随纳米粒子浓度的增加而降低,很明显1064 nm激光照射的癌细胞死亡率高于808 nm。还可以看到,用30 mu;g mL-1纳米粒子和1064 nm激光辐照处理的细胞的活力与用40 mu;g mL-1纳米粒子和808 nm激光辐照处理的细胞的活力相似。为了可视化光热纳米粒子的体外光热治疗效应,通过钙黄绿素-乙酰氧甲基(calcein-AM)和碘化丙啶(PI)区分活细胞(绿色)和死细胞(红色)。细胞用培养基(对照组和808、1064组)或纳米粒子(NPs、NPs 808、NPs 1064组)处理,激光照射(808 nm、1064 nm)或不照射。如图3c所示,对照组细胞大部分存活,分别为808、1064、NPs组,呈现亮绿色荧光。NPs 1064组细胞几乎全部呈现红色荧光,而NPs 808组细胞也有部分呈现绿色荧光,这与MTT结果一致(图3b),进一步证实了1064 nm激光照射具有较好的治疗效果。
图3. 光热纳米粒子对人肝癌细胞的细胞摄取和细胞毒性。(a)人肝癌细胞与NR@NPs在37 °C孵育0.5 h和2 h的共聚焦激光扫描显微镜图像。(b)在808 nm或1064 nm激光辐照(1.0 W cm-2,10分钟)或不使用激光辐照的情况下,用不同浓度的光热纳米粒子培养的人肝癌细胞的细胞活力。(c)钙黄绿素-AM(绿色,活细胞)和PI(红色,死细胞)共染色的人肝癌细胞的荧光图像,将其与培养基或光热纳米粒子孵育,然后用808 nm或1064 nm激光照射(1.0 W cm-2)处理 10分钟或不使用激光照射。
光热纳米粒子在体内的生物分布。为研究纳米粒子在体内的分布,在不同时间点(0、1、3、6、9、12、24、48和72 h)分别切除了小鼠的主要器官(心脏,肝脏,脾脏,肺和肾脏)。静脉注射72 h后(2.87 mg kg-1),记录其在1064 nm激光照射(1.0 W cm-2,10 min)下的温度变化,以确定纳米粒子在各个器官中的相对分布。图S12显示了相应的器官红外热图像。根据相同照射时间下治疗组的温度升高(Delta;T)与未治疗组的温度变化(Delta;T0)的比率,比较每个器官中纳米粒子的积累。如图S13所示,纳米粒子主要在小鼠的肝脏和脾脏中积累,并且在给药24小时后肝脏中的积累达到最大,然后逐渐减少。因此,在随后的原位肝癌的体内光热治疗中,小鼠肝的最佳照射时间是静脉内给药后约24小时。
纳米粒子在体内对肝脏肿瘤的作用。基于以上结果,我们研究了纳米粒子对H22原位荷瘤小鼠在808 nm和1064 nm激光照射下的体内光热效应。荷瘤小鼠随机分为三组,即对照组,808 nm和1064 nm。鉴于细胞毒性实验的结果(图3b),为了忽略不同吸光度对纳米粒子在808和1064 nm时的影响,808 nm组(4.31 mg kg-1)的剂量是1064 nm组(2.87 mg kg-1)的1.5倍。在注射纳米粒子 24小时后,分别通过808nm或1064 nm激光(1.0 W cm-2,10分钟)照射80
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[240219],资料为PDF文档或Word文档,PDF文档可免费转换为Word
课题毕业论文、开题报告、任务书、外文翻译、程序设计、图纸设计等资料可联系客服协助查找。



