针对实时双色成像的双相受激拉曼散射显微术外文翻译资料
2022-05-29 22:59:18

英语原文共 4 页,剩余内容已隐藏,支付完成后下载完整资料
针对实时双色成像的双相受激拉曼散射显微术
摘要
带有化学对比度的免标记组织学在手术术中快速诊断上具有很大的应用潜力。双色受激拉曼散射(SRS) 显微技术已经在免标记数字组织学上取得了成功,其诊断结果与苏木精-伊红染色法(Hamp;E)相似。然而,实现实时双色SRS成像仍然存在挑战。我们精确设计了斯托克斯光束的脉冲包络,并充分利用锁相放大器的X和Y输出端口来实现双色同时成像。这种方法在传输模式和后向模式中都可以达到单色SRS的最大速度,并且可以保证它的鲁棒性以及在实时组织学和动物活体成像上的优势。此外,该方法可以简单地移植到其他基于泵浦-探测方法的显微术中。
正文
作为一种相干拉曼散射成像技术,受激拉曼散射显微术在量化化学分析、活细胞药物输运、DNA成像和肿瘤探测上显现了独一无二的能力。受激拉曼散射(SRS)的主要优势在于其不需要任何外援标记物的高灵敏度和化学特异性。一方面,SRS继承了在“指纹”光谱特征区,本征分子标志物自发拉曼散射的振动波谱;另一方面,它的非线性和相干光学过程将拉曼信号放大了3-5个数量级,使得快速成像和灵敏探测成为可能。因此,实现更好的波谱显微和更高的成像速率是该领域长期的追求。然而,要想同时达到这两个目标还非常困难。单色相干拉曼散射能达到最高的成像速率(至视频码率),但是它牺牲了光谱信息和化学分辨率。在另一个极端,高光谱SRS和宽带相干反斯托克斯拉曼散射设法做到了在好的光谱分辨率下覆盖宽的波谱范围,但是以更多像素积分时间作为代价。
SRS光谱成像技术能分成两个主要的类别:顺序和并排方式。顺序方式依靠窄带激光器的波长扫描技术,包括机械和电光方法的波长选择,但因为在波长调谐过程中存在不可避免的时间消耗,其速率受到限制。并排方式要配合宽带激光器,它又分为两种类型:色散探测和复用调制技术。色散探测技术是基于与阵列探测器和解调器置于一块的分光计工作的,该分光计被限制于对薄的样品进行传输模式成像。复用调制技术包含一个光谱调制宽带激发光束和一个点探测器,随后是傅里叶变换器以获取光谱信息,但它的最高成像速率大约是60mu;s/像素。其他方法包括特定激励SRS和傅里叶变换SRS也被演示,但它们极大地被其复杂性和速度所限制。尽管有这些努力,但是,多化学元素对比度实时组织学成像从来没有在活动物后向模式中实现,而这却是SRS显微术向临床医学转变的关键一步。
我们之前演示了双色SRS显微术作为免标记组织学工具,描绘肿瘤和正常组织边界的潜力。相比于单色成像,双色SRS提供了更好的细胞密度、核形态学、轴突密度等等的对比度,产生的诊断结果和Hamp;E染色法相似,Hamp;E染色法是在组织学上广泛应用的金标准。在某种程度上说,Hamp;E也可以视为一种双色成像方式,苏木精和伊红分别标记了DNA和蛋白质。比起Hamp;E,SRS最大的优势在于它能够对新鲜的、未被加工的组织进行成像,因此,它有潜力作为不需要活组织切片检查的、活体诊断的快速免标记组织学工具。为了达到这个目的,它的成像速度需要在双色对比下得到最大化。
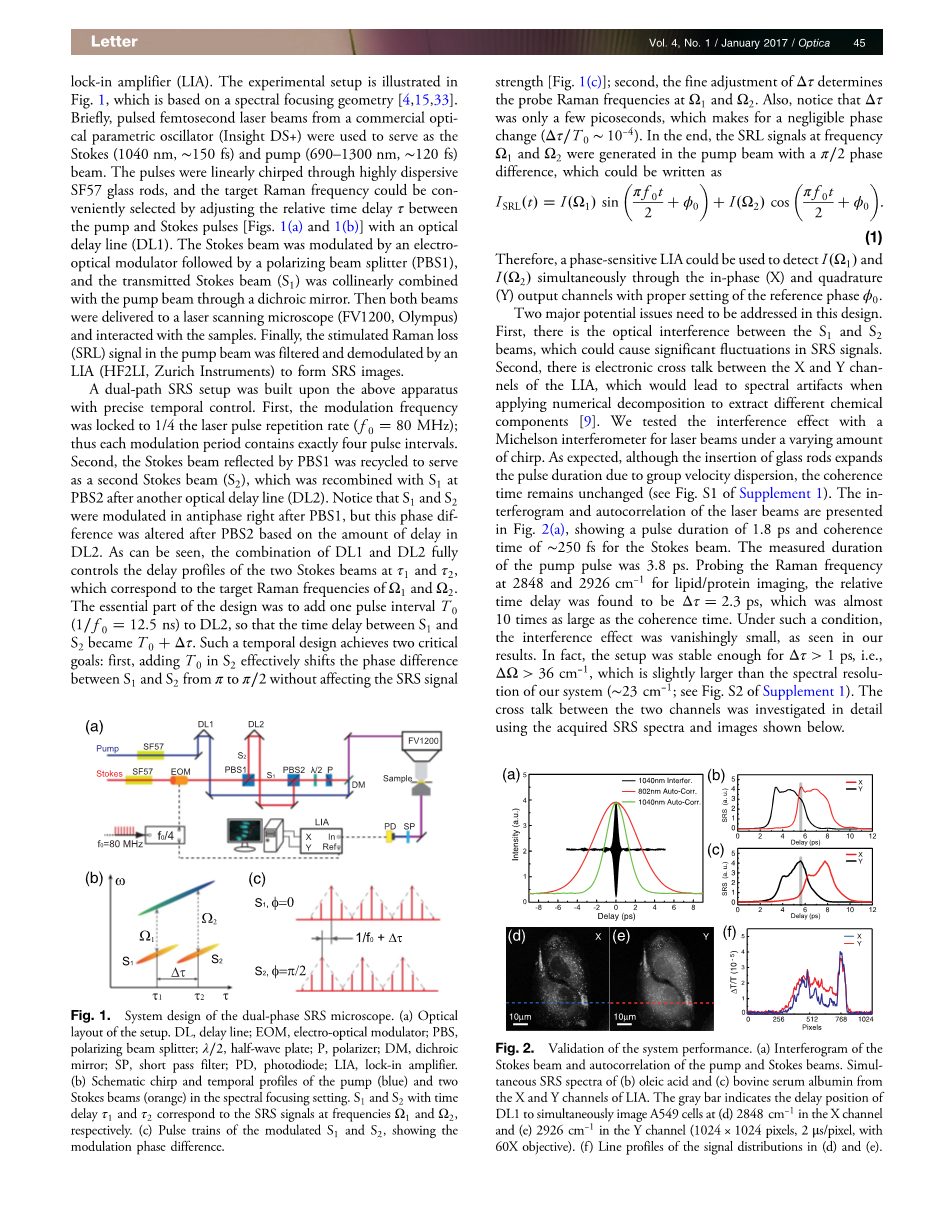
在这次工作中,我们展示了一个简洁的、有两个正交输出的双相锁相放大器的并排双色SRS显微术设计。基于光谱聚焦几何的实验装置绘制在图1中。简要来说,从商用光学参量振荡器(Insight DS )产生的1040nm、约150fs的飞秒脉冲激光光束被用于作为斯托克斯光,690-1300nm、约120fs的光束作为泵浦光。这两个脉冲通过SF57高色散玻璃棒被线性啁啾,并且,目标拉曼频率可以通过一个光学延迟线(DL1)调整泵浦和斯托克斯光的相对时间延迟tau;简单的进行选择。斯托克斯光被电光调制器调制,其后跟随着一个极化光分束器(PBS1),传输的泵浦光通过一个二相色镜与斯托克斯光(S1)交汇。这两束光被传送至激光扫描显微镜(FV1200,Olympus)并和样品相互作用。最后,在泵浦光束中的受激拉曼损失(SRL)信号被滤出,并被一个锁相放大器(HF2LI,Zurich Instruments)解调以形成SRS图像。
一个双路SRS装置在一个具有精密时间控制的仪器上组建形成。首先,调制频率被锁定为激光脉冲重复频率(80MHz)的1/4;因此,每一个调制周期都恰好包含4个脉冲间隔。其次,被PBS1反射的斯托克斯光束被再利用,从而作为第二束斯托克斯光(S2),S2在经过另一个光学延迟线(DL2)后和S1重合。需要注意的是,S1和S2在经过PBS1后,相位调制为反向,但该相位差异在PBS2后由于DL2的延迟效应而被改变。正如我们所见,DL1和DL2的联合完全控制了两束斯托克斯光在tau;1和tau;2的延迟状态,该延迟与目标拉曼频率Omega;1和Omega;2相关。该设计的最重要的部分是加入了一个脉冲间隔T0(12.5ns)至DL2中,因此,S1和S2的时间延迟变成了T0 Delta;tau;。这样一个时间设计实现了两个至关重要的目的:第一,在S2中加入T0后,有效的将S1和S2之间的相位差从pi;改变为pi;/2,而不影响SRS信号的强度;第二,Delta;tau;的良好调节决定了在Omega;1和Omega;2的探测拉曼频率。并且,注意到Delta;tau;只有几个皮秒(Delta;tau;/ T0约为10-4),在相位改变中微不足道。最后,在泵浦光束中产生的频率为Omega;1和Omega;2的SRL信号有pi;/2的差异,它可以写成
因此,一个相敏LIA可以用来通过合适设置了参考相位的X和Y输出通道来同时探测和。
这个设计的两个主要潜在问题需要被着重强调。第一,S1和S2之间有光学干涉,这可能对SRS信号造成显著波动。第二,LIA的X和Y通道之间存在电串扰,这可能导致在利用数值解谱提取不同化学成分时出现波谱重影。我们使用一个迈克尔逊干涉仪测试了激光光束在不同啁啾下的干涉效应。正如我们所预料到的,尽管光路中插入了玻璃棒使脉冲在群速度色散效应的作用下拓展了脉冲持续时间,但相干时间并没有改变。激光束的干涉图和自相关图如图2(a)所示,其展示了斯托克斯光束1.8ps的脉冲持续时间和大约250fs的相干时间。泵浦光脉冲测量的持续时间为3.8ps。探测脂质/蛋白质在2848和2926cm-1的拉曼频率用于成像,其相对时间延迟为2.3ps,大约是相干时间的10倍。在这种情况下,和我们的结果一致,干涉效应非常微弱。事实上,这个装置在Delta;tau;gt;1ps(也就是,Delta;Omega;gt;36cm-1)时足够稳定,这只比我们系统的光谱分辨率(约23cm-1)稍微大一点。利用获取的SRS波谱和如下所示的图像,详细地探究了两个通道之间的电串扰。
我们首先通过标准测试化学物质(油酸和牛血清蛋白)获取SRS波谱以评估系统。从X和Y通道获得的SRS波谱通过保持DL2不变(保证Delta;tau;=2.3ps)扫描DL1的方式被同时记录下来。LIA的参考相位被优化以使X和Y通道之间的电串扰最小,就像我们看到的,当斯托克斯光S1/S2被遮挡,它相应的X/Y通道的信号就会消失。当两束光都打开,两个输出通道产生扭曲很小的、几乎完全一样的波谱,这表明当不用光束扫描探测SRS时,串扰和干涉效应微不足道。
接下来,我们对活细胞进行传输模式成像。利用光束扫描,探测激光光点沿着大面积光电二极管移动,这可能造成射频相位的改变并产生空间相关的串扰。为了最小化这样一个效应,我们将PD放置在聚光镜入瞳成像平面,在这个位置,光点大且移动小。我们采用培养A549细胞的方法来评估串扰,该方法是在获取双相SRS信号时,于保证Delta;tau;=2.3ps的前提下改变DL1的位置。更多的细节分析请见支撑材料1的图4,表明串扰的幅度大约是2%。当DL1的延迟被适当设置,双相SRS可以同时探测2848和2926cm-1,如图2(d)和2(e)所示,细胞内脂质和蛋白质分布清晰可见,谱线轮廓绘制于图2(f)中。
并排探测方法在减少成像时间上有一个重大的优势,尤其是在处理类似于组织切片这样的大样本时。我们展示了小鼠大脑冠状切片的双相SRS成像。我们的结果重复了之前通过顺序波长调谐得到的结果(二者相一致),但减少了50%的总所需时间(约30min)。所有的大脑结构细节,就像脂质(绿色)和蛋白质(蓝色)的分布,在图3中清楚的展示出来。基于细胞形态的密度的组织学特征已经可以看见,并且和之前报道中所说的那样,可以用于诊断。传输模式下组织成像的串扰幅度被发现为和细胞成像模式相似。我们也提供了滑动扫描时,实时组织学现场模拟诊断。这些结果表明我们的方法对于快速免标记组织学的应用潜力。
我们的双相SRS技术提供了一个活体成像的优异工具。它的并排特性消除了在顺序多色成像方法中几乎不可避免的动态重影问题。原则上说,它可以达到单色SRS的最高成像速度。我们在传输模式下对活动物进行成像,旨在对血红蛋白和蛋白质含量的同时测绘,血红蛋白和蛋白质的波谱在支撑材料1的图6中展示。斑马鱼胚胎(受精后5天)的心跳用500ns(我们系统的最短时间)的像素滞留时间进行记录,其成像速率为8帧/s。如图4(a)和示意图2所示,我们观测了快速流动的椭圆形血细胞在斑马鱼心脏中的流进和流出过程,也对早期发展阶段的血红蛋白进行定位。我们还实时捕获了在小鼠耳朵中的血液流动,小鼠耳朵中单个红血细胞可以清楚的可视化。这些结果证明了我们的方法在快速移动物体上的鲁棒性,且不存在任何可探测的移动重影或串扰。
我们使用一个特殊设计的环形探测器来收集背向散射的光子,对活动物进行后向模式成像以进一步验证我们的方法效果。在我们的计划中,激光光束通过光电二极管和滤光片的中央孔径,并被聚焦入样品上和被扩散传播至组织处。这个背向散射光子被光电二极管收集,形成一个大光点,在光束扫描或聚焦深度改变(100mu;m以内)时,光点的位置移动和形状变化预计会很小。如图4(c)所示,不同深度的小鼠皮肤的活体双色成像被获取,展示了角质层、皮脂腺和脂肪细胞的脂质/蛋白质的轮廓。尽管SNR信噪比有所下降(约50下降至约10),造成了测量过程中更大的不确定性,但在整个成像深度内,串扰小于4%。我们这个方法在后向模式中的成功展示了其在免标记手术术中成像和诊断上的巨大潜力。
之前所有SRS波谱成像的方法都被视作是频域技术,要么是在光频域中,如波长扫描和色散探测,要么是在调制复用的射频域中。这个原理的本质是基于不同频率的傅里叶分量的正交特性。与此相反,我们的方法是利用正弦和余弦函数之间的正交性,并打开了一条提取波谱信息的新道路。将这么一个概念和存在的频率域方法相结合以进一步改善多色SRS的成像速度也是可能的。
我们这个设计的简易性使得它在简单维护和灵活性上成为可能。例如,我们可以通过简单地遮挡S2的光束的方法,将其立即恢复成一个普通的SRS装置。并且,如果我们减小DL2的T0时间,那么S1和S2处于调制的反相状态,它成为一个探测-信号差值的频率调制的SRS系统,虽然频率调制SRS是单色成像系统的基本。一旦我们的双色装置被优化,这将不再需要在获取图像的过程中,调谐激光的光波长或者移动任何机械部件,因此,更好的稳定性和耐久性可以被实现。
除了快速组织学和手术术中成像之外,更多的潜在应用可以被发现来支持我们的方法。目前,各种各样的生物医学问题涉及到流体系统,如基于脂质/蛋白质的细胞分析和流式细胞术的平台排序,斑马鱼和其他动物的血液学,和循环肿瘤细胞的活体探测。最后但并不是最不重要的,这个方法可以应用于其他基于泵浦-探测的显微术中去,以完成两种成分的同时成像,提供它们所具有的显著瞬态行为。
总结而言,我们设计了一个紧凑简洁的、具有精确时间管理的双色SES显微术装置,它可以通过双相锁相放大器X和Y输出通道来同时探测两个拉曼频率。我们演示了在培养细胞、组织切片和活动物成像中的原理论证结果,包括传输和后向两种成像模式。我们的方法提供了一个简单的方法来实现实时双色SRS成像,并且,它可以在生物医学研究中找到新的发展潜力。
图1 双相SRS显微术的设计装置.(a)该装置的光学布局. DL,延迟线;EOM,电光调制器;PBS,极化光分束器;lambda;/2,半波片;P,偏振片;DM,二相色镜;SP,短通滤波片;PD,光电二极管;LIA,锁相放大器.(b)啁啾原理图和在光谱聚焦装置中泵浦光(蓝色)和两束探测光(橘黄色)的时间包络.时间延迟为tau;1和tau;2的S1和S2分别对应SRS信号的Omega;1和Omega;2频率.(c)调制的S1和S2脉冲序列,显示了调制相位差异.
图2 系统性能的验证.(a)斯托克斯光束的干涉图和泵浦光和斯托克斯光的自相关图.油酸(b)和牛血清
全文共5611字,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[11595],资料为PDF文档或Word文档,PDF文档可免费转换为Word
课题毕业论文、开题报告、任务书、外文翻译、程序设计、图纸设计等资料可联系客服协助查找。



